Proteinfaltung und posttranslationale Modifikationen
IMPP-Score: 0.2
Proteinfaltung und Chaperone
Grundlagen der Proteinfaltung
Proteinfaltung ist ein kritischer Prozess, durch den Polypeptidketten ihre funktionelle dreidimensionale Struktur annehmen. Jedes Protein muss korrekt gefaltet werden, um seine spezifische Funktion in der Zelle ausüben zu können. Fehlgefaltete Proteine können nicht nur funktionsunfähig sein, sondern auch zu Krankheiten wie Alzheimer oder Parkinson führen.
Rolle der Chaperone
Chaperone sind spezielle Helferproteine, die andere Proteine dabei unterstützen, ihre korrekte Form zu finden, ohne permanent in deren Struktur integriert zu werden. Ein Beispiel hierfür ist das Chaperon Hsp70, das sich transient an neu synthetisierte Polypeptidketten anlagert und durch ATP-verbrauchende Zyklen dabei hilft, Fehlfaltungen zu verhindern oder zu korrigieren. Ein weiteres wichtiges System sind die Chaperonine, die eine Art “Fass” bilden, in dem sich einzelne Polypeptidketten ungestört falten können.
Das IMPP fragt besonders gerne nach der Rolle und Funktion der Chaperone im Faltungsprozess. Stellt sicher, dass ihr die Mechanismen versteht, wie Chaperone die Proteinfaltung fördern und welche Arten von Chaperonen beteiligt sind.
Signalpeptide und ihre Verarbeitung
Signalsequenzen und Signalpeptidase-Komplex
Signalpeptide sind spezielle Sequenzen am Anfang der Polypeptidkette, die signalisieren, wo ein Protein innerhalb der Zelle hin transportiert werden soll. Sind diese Signalpeptide vorhanden, wird das naszierende Protein ins raue endoplasmatische Retikulum (rER) eingeleitet. Dort wird das Signalpeptid durch den Signalpeptidase-Komplex abgespalten, was für die korrekte Adressierung und Funktion des Proteins entscheidend ist.
Abspaltung des Signalpeptids
Der Mechanismus der Abspaltung ist für den korrekten Transport des Proteins zu seinem Bestimmungsort innerhalb der Zelle entscheidend. Solche detaillierten Mechanismen sind oft Prüfungsthema beim IMPP.
Posttranslationale Modifikationen
Ubiquitinylierung und Proteasom
Posttranslationale Modifikationen sind chemische Veränderungen, die nach der Synthese eines Proteins erfolgen. Eine solche Modifikation ist die Ubiquitinylierung, bei der Ubiquitinmoleküle an ein Protein angehängt werden. Dies dient oft als Signal für den Abbau des markierten Proteins durch das Proteasom. Dieser Vorgang ist wesentlich für die Regulierung der Proteinqualität und -quantität in der Zelle.
Glykosylierung
Die Glykosylierung ist eine weitere wichtige posttranslationale Modifikation, bei der Zuckerreste an bestimmte Stickstoff- oder Sauerstoffatome des Proteins angehängt werden. Diese Modifikation findet typischerweise im ER und im Golgi-Apparat statt und ist entscheidend für die Stabilität, Faltbarkeit sowie die Funktionalität des Proteins.
Während der Proteinfaltung im ER können Disulfidbrücken zwischen den Cysteinresten der Polypeptidkette entstehen. Diese kovalenten Bindungen sind wichtig für die strukturelle Integrität und die funktionale Aktivität von Proteinen.
Zusammenfassung
Feedback
Melde uns Fehler und Verbesserungsvorschläge zur aktuellen Seite über dieses Formular. Vielen Dank ❤️
Footnotes
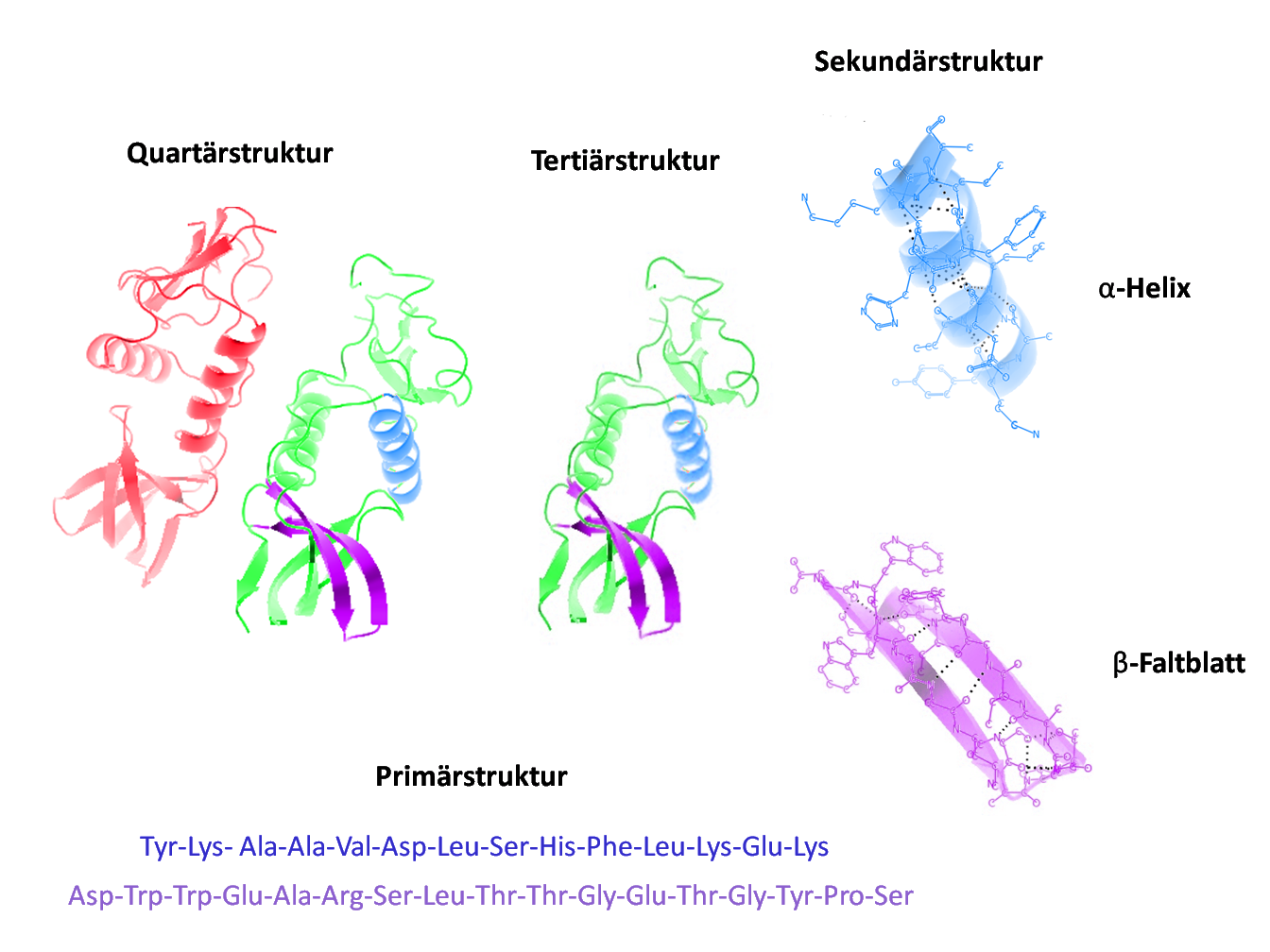
Credits Die verschiedenen Proteinstrukturen. Grafik: Holger87, Protein-Struktur, CC BY-SA 3.0↩︎
