G-Protein-gekoppelte Rezeptoren
IMPP-Score: 0.6
Grundlagen von G-Protein-gekoppelten Rezeptoren (GPCRs)
G-Protein-gekoppelte Rezeptoren (GPCRs) bilden eine große Familie von Membranrezeptoren, die essentiell für zahlreiche physiologische Prozesse in euren Zellen sind. Sie erkennen eine Vielzahl von Liganden, von Hormonen wie Adrenalin bis zu Neurotransmittern wie Acetylcholin, und leiten Signale in die Zelle weiter, was zu verschiedensten zellulären Antworten führt.
Struktur und Aktivierungsmechanismus
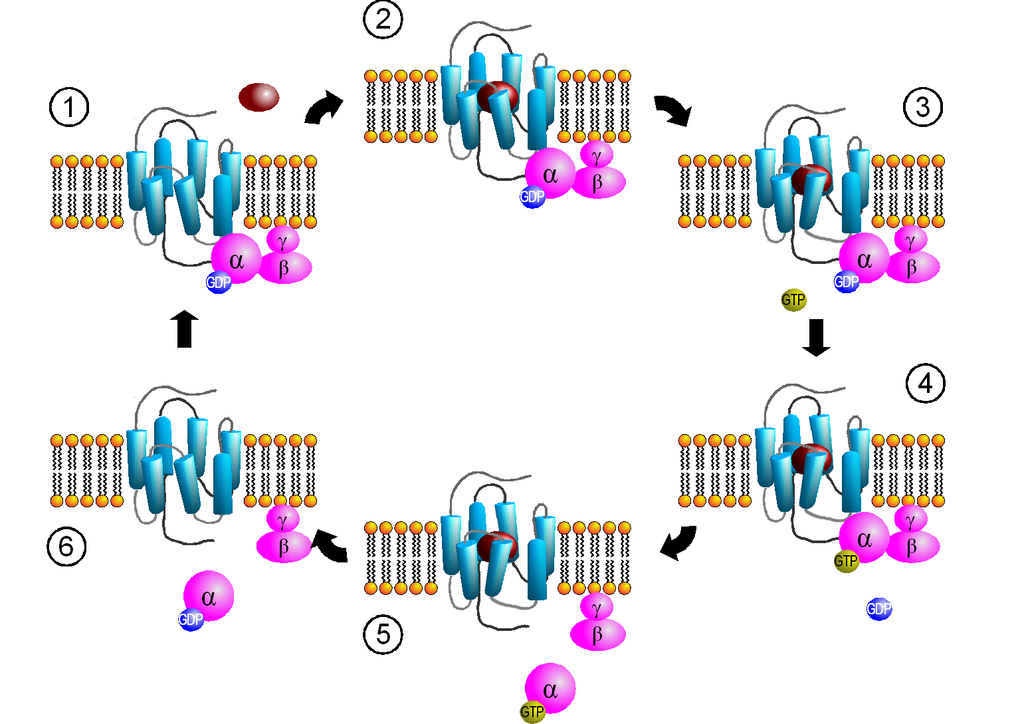
GPCRs bestehen aus einer einzelnen Polypeptidkette, die siebenmal die Zellmembran durchspannt. Diese Rezeptoren sind über intrazelluläre Proteine, die G-Proteine, mit dem zellulären Signaltransduktionssystem verbunden. Ein G-Protein setzt sich aus drei Untereinheiten zusammen: \(\alpha\), \(\beta\) und \(\gamma\).
Das IMPP fragt besonders gerne nach der initialen Aktivierung von GPCRs und deren Auswirkungen auf die G-Proteine. Dabei ist von zentraler Bedeutung, dass ihr versteht, wie die Bindung eines externen Liganden zum Austausch von GDP zu GTP auf der \(\alpha\)-Untereinheit führt.
Wenn ein Ligand an einen GPCR bindet, erfolgt eine Konformationsänderung, die bewirkt, dass das am GPCR gebundene G-Protein sein gebundenes GDP freigibt und stattdessen GTP bindet. Dies aktiviert die \(\alpha\)-Untereinheit. Die GTP-beladene \(\alpha\)-Untereinheit trennt sich dann von den \(\beta\)- und \(\gamma\)-Untereinheiten, wodurch zwei aktive Einheiten entstehen, die jeweils weiter in der Zelle agieren können.
Signaltransduktionswege und Effekte der Aktivierung
Hemmung und Aktivierung von Adenylatzyklase
Die adrenergen Rezeptoren, die zu den GPCRs gehören, können nach ihrer Aktivierung durch Adrenalin entweder die Adenylatzyklase aktivieren, was zu einer Erhöhung von cAMP in der Zelle führt, oder ihn hemmen, was die cAMP-Konzentration senkt. Dies hat direkte Auswirkungen auf die Aktivität anderer zellulärer Proteine, besonders von Proteinkinasen.
Modulation von Ionenkanälen
Die durch G\(\beta\gamma\) freigesetzten Untereinheiten sind oft direkt in der Lage, Ionenkanäle in der Zellmembran zu modulieren. Diese Veränderung der Ionenkanalaktivität kann schnelle Veränderungen im Membranpotenzial verursachen, was besonders in Nervenzellen von großer Bedeutung ist.
Aktivierung von Proteinkinasen
Weiterhin können GPCRs über G\(\alpha\)-Untereinheiten verschiedene Typen von Proteinkinasen aktivieren, die wiederum breite Kaskaden von Phosphorylierungsreaktionen in der Zelle auslösen und so viele verschiedene zelluläre Prozesse regulieren.
Second Messenger Systeme und ihre Rolle
GPCRs spielen eine zentrale Rolle bei der Generierung von “second messengers” wie cAMP, Inositoltrisphosphat (IP3) und Diacylglycerol (DAG). Diese Moleküle helfen dabei, das ursprüngliche Signal des ersten Botenstoffes (den Liganden) zu verstärken und weiterzuleiten.
Downstream-Effekte und Rückkopplungsmechanismen
Nachdem die Signalwege aktiviert wurden, führen sie zu einer Vielzahl von Reaktionen in der Zelle, darunter Veränderungen in der Genexpression und im Metabolismus. Auch die Beendigung der Signalübertragung ist wesentlich, was durch Mechanismen wie die Endocytose und die Degradation der Rezeptoren erfolgt.
Denkt immer daran, dass die genaue Kenntnis der verschiedenen GPCR-Typen und ihrer spezifischen Effekte und Downstream-Signalwege für das Verständnis ihrer Rolle in zellulären und physiologischen Prozessen essenziell ist.
Der Einsatz von interaktiven Modellen oder Schemata zur Veranschaulichung dieser Prozesse kann sehr hilfreich sein, um das komplexe Netzwerk der GPCR-Signaltransduktion zu verstehen.
Zusammenfassung
Feedback
Melde uns Fehler und Verbesserungsvorschläge zur aktuellen Seite über dieses Formular. Vielen Dank ❤️
Footnotes
Credits Aktivierungszyklus von G-Proteinen durch G-Protein-gekoppelte Rezeptoren: (1) Bindung des G-Proteins; (2) Ligandenbindung; (3) Aktivierung des Rezeptors; (4) Aktivierung des G-Proteins; (5) Dissoziation des G-Proteins und Signaltransduktion; (6) Inaktivierung des G-Proteins Grafik: Sven Jähnichen, GPCR-Zyklus, CC BY-SA 3.0↩︎