Der Aufbau von Virionen und Unterschiede im Genomaufbau von Viren
Viren sind faszinierende Mikroorganismen, deren einfache Struktur ausreicht, um komplexe Infektionszyklen auszulösen. In diesem Abschnitt beschäftigen wir uns genau damit – dem Aufbau von Virionen und den Unterschieden im Genomaufbau.
Grundstruktur von Viren
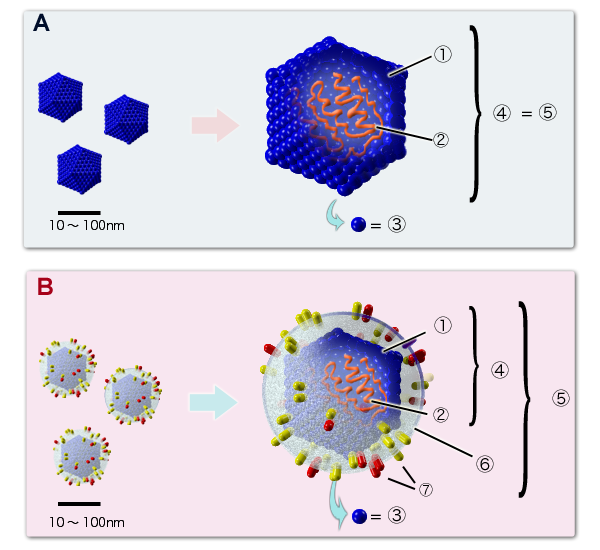
Ein Virion ist die vollständige, infektionsfähige Form eines Virus außerhalb einer Zelle. Obwohl es sich im Vergleich zu anderen Mikroorganismen um eine vergleichsweise einfache Struktur handelt, gibt es zwischen verschiedenen Viren erhebliche Variationen.
Nukleinsäuren
Jedes Virus enthält eine Art von Nukleinsäure, entweder DNA oder RNA, die entweder einsträngig (single-stranded, ss) oder doppelsträngig (double-stranded, ds) sein kann. Zum Beispiel: - Bakteriophagen, Viren die Bakterien infizieren, können DNA oder RNA als genetisches Material enthalten, die sowohl ss als auch ds sein kann. - HI-Viren (HIV) besitzen eine einzelsträngige RNA, die durch Reverse Transkriptase in DNA umgeschrieben wird, um in der Wirtszelle replizieren zu können. Dies ist ein Schlüsselmerkmal der Retroviren.
Kapsid
Das Kapsid ist eine Proteinstruktur, die das virale Genom umschließt. Diese Proteinhülle schützt die genetische Information des Virus und unterstützt die Anheftung an und den Eintritt in Wirtszellen. Das Kapsid ist aus Untereinheiten aufgebaut, den sogenannten Capsomeren.
Faszinierendes Detail
Die Capsomere sind so perfekt angeordnet, dass sie durch ihre Selbstorganisation das Kapsid formen. Dies ist ein beeindruckendes Beispiel für molekulare Selbstassembly in der Biologie.
Virushülle
Einige Viren besitzen zusätzlich eine Lipidhülle (oft einfach als “Hülle” bezeichnet), die sie von der Wirtszelle abgreifen, wenn sie die Zelle verlassen. Ein klassisches Beispiel sind die Influenza-Viren und HIV, die durch diese Hülle, die mit Glykoproteinen bestückt ist, zusätzliche Proteine wie Hämagglutinin und Neuraminidase tragen. Diese Proteine sind essentiell für das Andocken an und das Eindringen in Wirtszellen.
Spezifika der viralen Proteine und ihre Replikation
Enzyme und Replikationsmechanismen
Die RNA-abhängige RNA-Polymerase wird von (-)-ssRNA-Viren genutzt, um neue RNA-Stränge zu synthetisieren, da Wirtszellen dieses Enzym nicht besitzen. Retroviren wie HIV nutzen hingegen die Reverse Transkriptase, um ihre RNA in DNA umzuschreiben. Diese unterschiedlichen Strategien zeigen, wie Viren ihren Lebenszyklus an ihre Umgebung und an ihre Möglichkeiten innerhalb der Wirtszelle anpassen.
Eindringmechanismen und Lebenszyklus
Die vielfältigen Strukturen und Mechanismen, die Viren verwenden, verdeutlichen ihre Anpassungsfähigkeit und Komplexität:
- Lysogene vs. lytische Zyklen bei Bakteriophagen: Im lysogenen Zyklus integriert sich das Virale Genom in das Bakteriengenom und repliziert passiv mit der Wirtszelle, während im lytischen Zyklus neue Viren aktiv synthetisiert werden und die Wirtszelle zerstören.
- Eintritt von umhüllten Viren wie HIV: Diese Viren fusionieren ihre Hülle mit der Membran der Wirtszelle und lassen das Kapsid mit der viralen RNA in die Wirtszelle gelangen.
Besondere Aufmerksamkeit galt dabei Hämagglutinin und Neuraminidase bei Influenza-Viren, deren Rollen beim Anheften an und dem Eindringen in die Wirtszelle zentral sind.
Wichtig für das IMPP
Das IMPP fragt besonders gerne nach den spezifischen Enzymen und deren Funktionen in den verschiedenen viralen Zyklen, also stellt sicher, dass ihr diese Konzepte gut verstanden habt.
Dieser Überblick sollte euch ein klares Bild davon geben, wie vielseitig und spezialisiert Viren in ihren Strukturen und Lebenszyklen sein können. Es ist faszinierend zu sehen, wie solch winzige Entitäten komplexe biologische Mechanismen ausnutzen können.
Virale Replikationszyklen und Wirtszellspezifität
Lytischer vs. Lysogener Zyklus bei Bakteriophagen
Bakteriophagen, oft einfach Phagen genannt, sind einzigartig, weil sie gezielt Bakterien angreifen. Verstehe den Unterschied zwischen lytischem und lysogenem Zyklus, denn das IMPP fragt besonders gerne nach diesen Unterschieden.
Lytischer Zyklus: Virulente Phagen dringen in Bakterien ein und starten diesen Zyklus, was zur Zerstörung der Wirtszelle führt. Dieser Zyklus umfasst die Einführung der Phagen-DNA in die Bakterienzelle, die Produktion neuer Phagen durch die Übernahme der Maschinerie der Wirtszelle und schließlich die Lyse (das Platzen) der Bakterienzelle, um neue Viren zu entlassen.
Lysogener Zyklus: Temperente Phagen können diesen Zyklus durchlaufen, bei welchem das virale Genom als Prophage ins Genom der Wirtszelle integriert wird und nur dann in den lytischen Zyklus eintritt, wenn die Wirtszelle Stressfaktoren ausgesetzt ist. Bis dahin vermehrt sich die Phagen-DNA passiv zusammen mit der Wirtszell-DNA bei jeder Bakterienteilung.
Verstehe die Schlüsselunterschiede und die Bedingungen, unter denen ein Wechsel von lysogen zu lytisch erfolgen kann. Diese Konzepte sind zentral für das Verständnis der viralen Lebenszyklen und ihrer evolutionären Vorteile.
HI-Virus: Ein Beispiel für Retroviren
HI-Viren, Erreger des AIDS, demonstrieren die Komplexität von Retroviren. Die Replikation dieser Viren hängt von mehreren spezifischen Schritten ab:
Fusion und Eindringen: HIV bindet an den CD4-Rezeptor und den CCR5- oder CXCR4-Corezeptor auf der Oberfläche von T-Helferzellen. Das virale gp120 Protein spielt bei dieser Anheftung eine entscheidende Rolle.
Reverse Transkription: Im Virion enthaltene reverse Transkriptase wandelt die virale RNA in doppelsträngige DNA um.
Integration: Die durch Reverse Transkriptase gebildete DNA wird dann von einem weiteren viralen Enzym, der Integrase, in das Genom der Wirtszelle eingebaut. Dies ermöglicht es dem Virus, sich unbemerkt zu vermehren.
Transkription und Translation: Die virale DNA wird nun von der Wirtszelle abgelesen, um mRNA herzustellen, die dann in virale Proteine übersetzt wird, die für neue Virionen benötigt werden.
Die Fähigkeit von HIV, seine genetische Information in das Genom der Wirtszelle zu integrieren, macht es besonders schwer, das Virus zu bekämpfen und erklärt die langfristigen Herausforderungen bei der Behandlung von AIDS.
Spezifität der Virus-Wirt-Interaktion
Jedes Virus hat spezielle Mechanismen entwickelt, um spezifisch an seine Wirtszellen anzudocken. Dies erleichtert die effiziente Nutzung der zellulären Ressourcen des Wirts. Neben HIV-Beispielen:
Influenza-Virus: Bindet über das Hämagglutinin-Protein an Sialinsäure-Rezeptoren auf Zelloberflächen von Atemwegszellen.
Bakteriophagen: Besitzen oft Schwanzfasern oder andere Anhänge, die spezifisch bakterielle Oberflächenmarker erkennen.
Die Kenntnis dieser spezifischen Interaktionen ist entscheidend, weil sie Ziele für antivirale Therapien und Impfstoffe bieten.
Zusammenfassung
- Virionen Struktur: Virionen umfassen genetische Information (DNA oder RNA, einfach- oder doppelsträngig) eingehüllt in ein Proteinkapsid, manchmal zusätzlich geschützt durch eine Lipidhülle, die sie beim Verlassen der Wirtszelle erwerben.
- Mechanismen der Replikation: Unterschiedliche Viren nutzen spezifische Replikationsmechanismen, wie die Umwandlung von RNA in DNA durch Reverse Transkriptase bei Retroviren oder RNA-abhängige RNA-Polymerasen für (-)-ssRNA-Viren, um ihre Genomkopie innerhalb der Wirtszelle zu ermöglichen.
- Lebenszyklusvariationen: Viren zeigen in ihrem Lebenszyklus große Vielfalt, einschließlich lytischer und lysogener Zyklen bei Bakteriophagen, wobei Erstere die Wirtszelle zerstören und Letztere das virale Genom in die Wirtszelle integrieren.
- Spezifität der Wirtszellinfektion: Viren entwickeln spezialisierte Mechanismen, um sich an spezifische Wirtsrezeptoren zu binden, wie das gp120 Protein bei HIV, welches an CD4- und CCR5- bzw. CXCR4-Rezeptoren an T-Helferzellen bindet, was ihre Fähigkeit zur Infektion und Persistenz steigert.
- Bedeutung von Oberflächenproteinen: Die Proteine auf der Virusoberfläche, wie Hämagglutinin und Neuraminidase bei Influenza-Viren, sind entscheidend für die Anhaftung an und das Eindringen in Wirtszellen und beeinflussen die Effektivität von Impfstoffen und antiviralen Medikamenten.
Feedback
Melde uns Fehler und Verbesserungsvorschläge zur aktuellen Seite über dieses Formular. Vielen Dank ❤️