Proteine und ihre Bausteine
IMPP-Score: 0.4
Proteine und ihre Bausteine
Proteine sind Grundpfeiler des zellulären Lebens und erfüllen essentielle Funktionen in allen biologischen Systemen. Sie bestehen aus Aminosäuren, die über Peptidbindungen miteinander verknüpft sind. Dieser Abschnitt beleuchtet insbesondere die fundamentalen Aspekte von Aminosäuren und deren Rolle im Aufbau komplexer Proteinstrukturen.
Aminosäuren: Die Bausteine der Proteine
Aminosäuren sind organische Moleküle, die eine Amino- (\(-NH_2\)) und eine Carboxylgruppe (\(-COOH\)) besitzen. Jede Aminosäure verfügt zusätzlich über eine charakteristische Seitenkette oder R-Gruppe, die ihre einzigartigen Eigenschaften bestimmt wie Hydrophobizität, Ladung und Reaktivität.
Die Eigenschaften einer Aminosäure, wie Hydrophobizität und Ladung, spielen eine entscheidende Rolle bei der Faltung und Funktion von Proteinen.
Chemische Struktur und Klassifikation
Aminosäuren lassen sich in unterschiedliche Kategorien einteilen, basierend auf den Eigenschaften ihrer Seitenketten:
- Hydrophobe Aminosäuren wie Leucin, Isoleucin und Valin, die vorwiegend in den inneren Regionen von Proteinen zu finden sind, um Wasserkontakt zu vermeiden.
- Polare Aminosäuren wie Serin oder Threonin, die häufig an der Oberfläche von Proteinen auftreten und mit dem wässrigen Umgebung interagieren können.
- Saure und basische Aminosäuren, welche aufgrund ihrer geladenen Seitenketten an elektrostatischen Interaktionen beteiligt sind.
Die Peptidbindung: Grundlage der Primärstruktur
Die Primärstruktur eines Proteins wird durch die spezifische Sequenz von Aminosäuren bestimmt und durch Peptidbindungen zusammengehalten. Diese kovalenten Bindungen entstehen durch eine Kondensationsreaktion zwischen der Carboxyl- und der Aminogruppe benachbarter Aminosäuren.
Das Verständnis der chemischen Natur der Peptidbindung ist essenziell, da sie die unveränderliche Rückgratstruktur in allen Proteinen bildet.
Höhere Strukturebenen der Proteine
Die höheren Ordnungen der Proteinstruktur entstehen durch Faltungen und Interaktionen, die weit über die lineare Sequenz ihrer Aminosäuren hinausgehen.
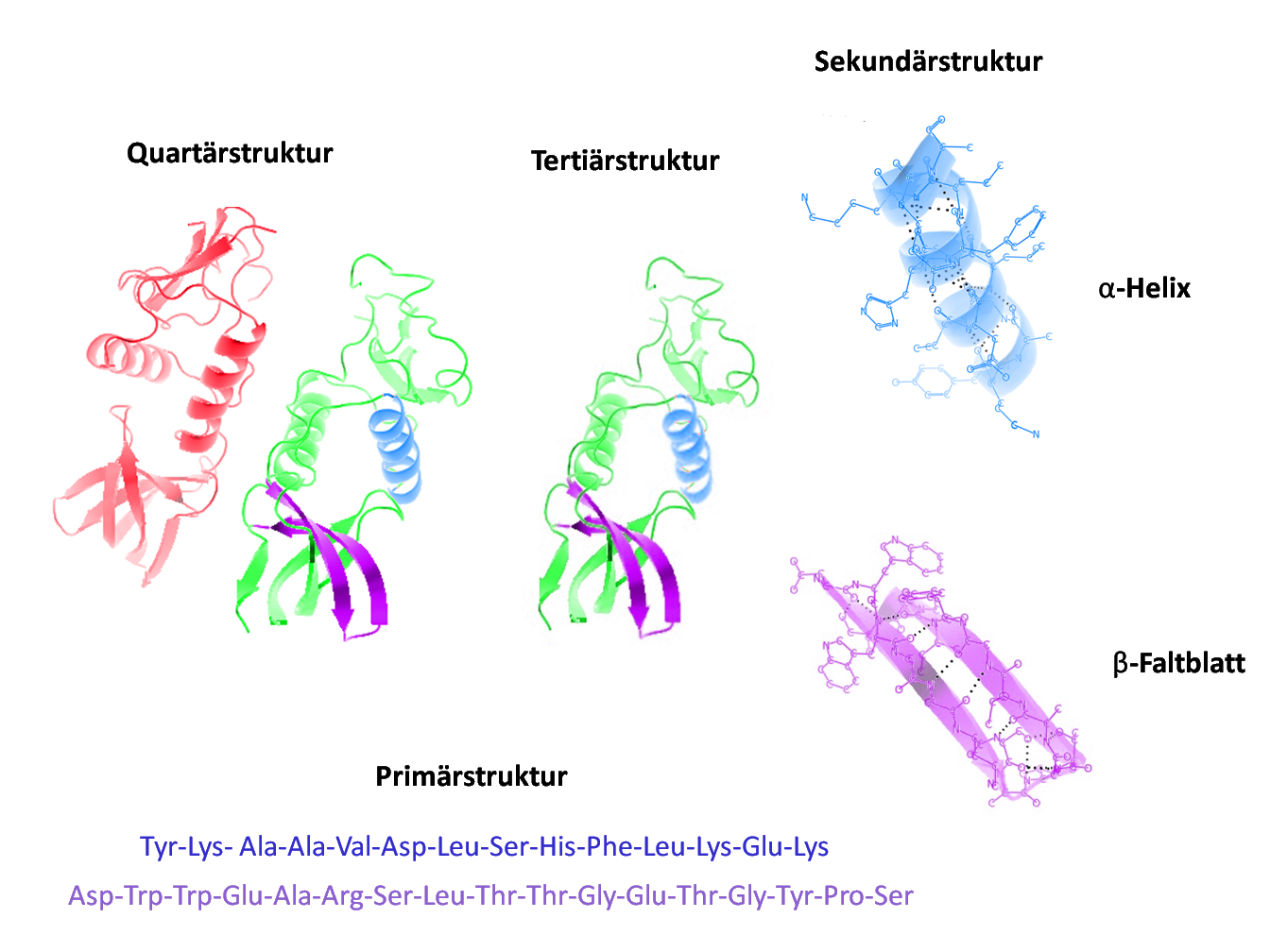
Sekundärstrukturen
Diese Strukturen, primär α-Helices und β-Faltblätter, entstehen durch regelmäßige Muster von Wasserstoffbrückenbindungen zwischen den Rückgrat-Atomen der Peptidbindungskette.
Beim α-Helix stabilisieren Wasserstoffbrückenbindungen jeweils die vierte Aminosäure entlang der Kette, während β-Faltblätter durch Wasserstoffbrücken zwischen ausgedehnten Peptidsträngen gebildet werden.
Tertiärstruktur
Die Tertiärstruktur beschreibt die dreidimensionale Form eines einzelnen Proteins. Sie wird durch eine Vielzahl von Wechselwirkungen wie hydrophobe Interaktionen, Wasserstoffbrücken und Salzbrücken, sowie durch Disulfidbrücken zwischen Cysteinresten stabilisiert.
Quartärstruktur
Einige Proteine bestehen aus mehreren Untereinheiten, deren räumliche Anordnung als Quartärstruktur bezeichnet wird. Diese Struktur ist essentiell für die Funktionalität von Protein-Komplexen wie den Histonen bei der DNA-Verdichtung zu Chromosomen.
Das IMPP fragt besonders gerne nach der Rolle der Quartärstruktur bei der funktionellen Regulation von Proteinen, wie z.B. bei Hämoglobin.
Abschluss
Die ausführliche Betrachtung der verschiedenen Strukturebenen von Proteinen verdeutlicht, wie Aminosäuren, als grundlegende Bausteine, durch ihre chemischen Eigenschaften und die daraus resultierenden Wechselwirkungen die unglaubliche Vielfalt der Proteinstrukturen und -funktionen innerhalb der Zelle ermöglichen.
Zusammenfassung
Feedback
Melde uns Fehler und Verbesserungsvorschläge zur aktuellen Seite über dieses Formular. Vielen Dank ❤️
Footnotes
Credits Faltung und struktur von Proteinen. Grafik: Holger87, Protein-Struktur, CC BY-SA 3.0↩︎