Allgemeines
IMPP-Score: 1.1
Grundlagen und Anwendungen der Konduktometrie
Die Konduktometrie ist ein faszinierendes Feld innerhalb der elektroanalytischen Verfahren, das sich von anderen Methoden wie der Voltammetrie, Amperometrie oder Coulometrie durch eine entscheidende Besonderheit abhebt: es misst die Leitfähigkeit einer Elektrolytlösung, ohne dass ein direkter Stoffumsatz an den Elektroden erforderlich ist. Dies ermöglicht eine Vielzahl von Anwendungen, von denen einige besonders relevant für eure Examen sein werden.
Theoretische Grundlagen
Einfach ausgedrückt, misst die Konduktometrie, wie gut eine Lösung elektrischen Strom leiten kann. Dies erfolgt durch die Messung des ohmschen Widerstands der Lösung, wobei die Grundlage bildet, dass Elektrolyte in Lösung ionisiert vorliegen. Jene Ionen bewegen sich im elektrischen Feld und tragen somit zum Stromfluss bei. Im Gegensatz zu Verfahren, die Stoffumsätze nutzen, verwenden wir bei der Konduktometrie Wechselspannung, um Polarisationsspannungen an den Elektroden zu verhindern, die sonst zu Fehlmessungen führen könnten.
Die Ionenleitfähigkeit, ein zentraler Faktor für die Messungen, wird stark von der Größe, Ladung und Hydrathülle der Ionen beeinflusst. Kleinere, höher geladene Ionen tendieren dazu, schneller zu wandern - das heißt, sie zeigen eine höhere Ionenleitfähigkeit. Ein interessantes Phänomen ist die hohe Leitfähigkeit der Hydronium- (\(H_3O^+\)) und Hydroxidionen (\(OH^-\)), die durch die Übertragung von Ladungen über Wasserstoffbrücken noch verstärkt wird.
Anwendung in Titrationen
Ein spannendes Anwendungsgebiet der Konduktometrie ist die Indizierung von Titrationen, insbesondere bei Säure-Base-Reaktionen. Nach dem Äquivalenzpunkt einer Titration verändert sich die Leitfähigkeit der Lösung bedeutsam, da neue Ionenarten oder Tarierungen von Ionenkonzentrationen auftreten. Besonders bei der Titration von schwachen Säuren mit starken Basen (oder umgekehrt) zeigt sich der Nutzen der Konduktometrie, da der Endpunkt über eine signifikante Änderung der Leitfähigkeit detektiert wird.
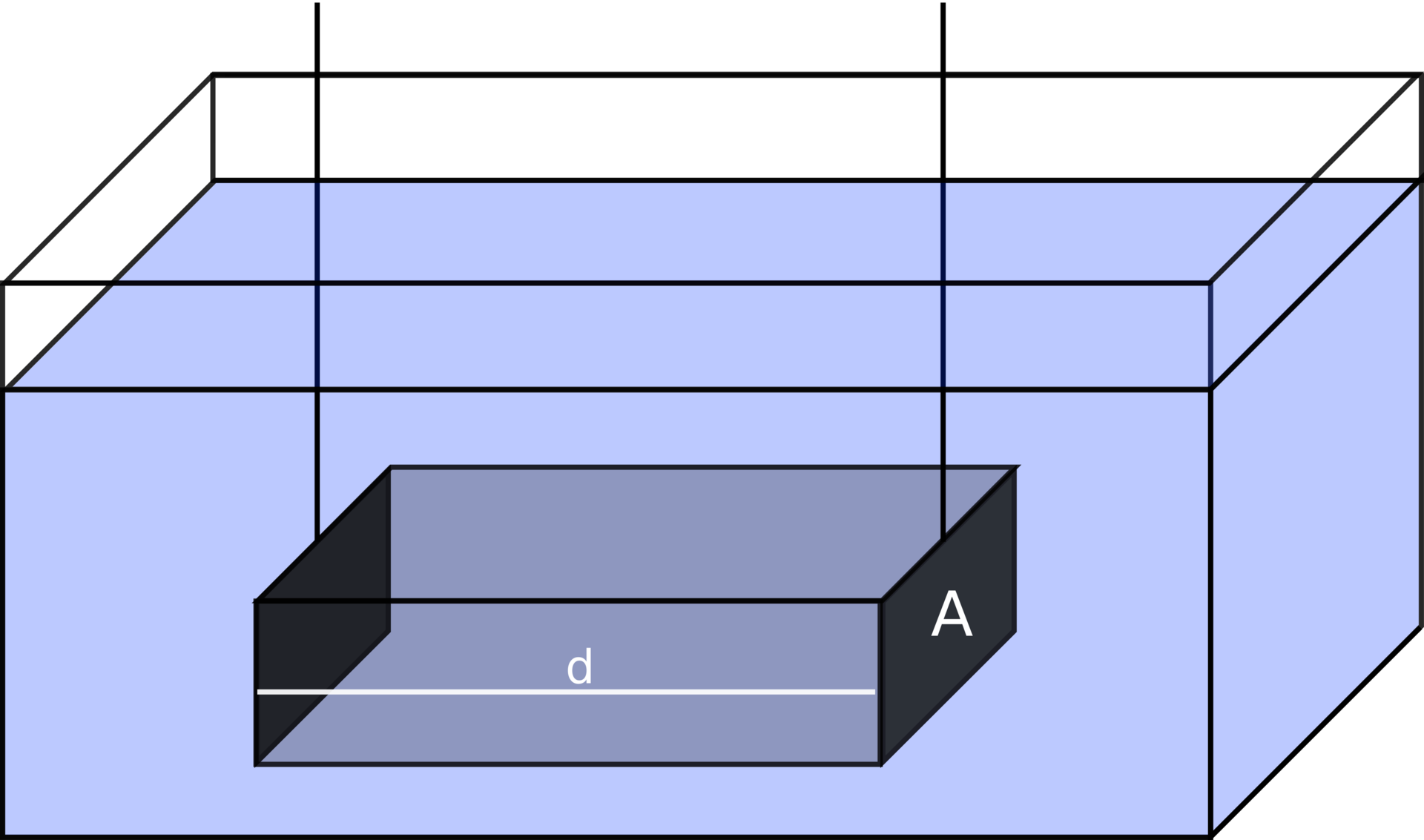
Konduktometrische Messanordnungen
Für genaue Messungen ist die Gestaltung der Messzelle von entscheidender Bedeutung. Die Elektrodenoberfläche wird oft platinisiert, um eine größere Oberfläche zu schaffen, und Wechselspannung wird angewandt, um Polarisation und Stoffumsatz an den Elektroden zu minimieren. Die Auswahl und Anpassung der Messzelle entsprechend der spezifischen Anwendung, wie etwa die Reinheitsprüfung von p-Sorbitol oder die Analyse von Ionenzusammensetzungen mittels Flüssigchromatographie, sind kritische Schritte für erfolgreiche Messungen.
Das IMPP fragt besonders gerne nach der Rolle von Ionenbeweglichkeiten und deren Einfluss auf die Messergebnisse der Konduktometrie. Versteht, dass die Ionenleitfähigkeit von der Ladungsdichte und Größe des Ions abhängt und dass Ausnahmen wie Hydroxid- und Oxoniumionen aufgrund ihrer besonderen Ladungstransportmechanismen hervorstechen.
Herausforderungen und Limitationen
Obwohl die Konduktometrie viele Vorteile bietet, ist sie nicht frei von Herausforderungen. Die Präsenz von mehreren Ionenarten in der Lösung kann die Interpretation der Leitfähigkeitsänderungen komplex gestalten. Außerdem beeinflusst die Temperatur die Messergebnisse durch ihren Einfluss auf Löslichkeit, Dissoziationsgrad und die Viskosität der Lösung, was bei der Durchführung und Analyse der Messungen berücksichtigt werden muss.
Die Konduktometrie ist ein vielseitiges Werkzeug in der analytischen Chemie, das durch die präzise Messung der Leitfähigkeit ohne Notwendigkeit eines Stoffumsatzes an den Elektroden, ein breites Spektrum an Anwendungen ermöglicht. Ob bei der Indizierung von Titrationen, der Prüfung von Arzneimitteln auf Reinheit oder der Analyse von Ionenzusammensetzungen - die Grundlagen und Prinzipien der Konduktometrie bieten wertvolle Einblicke und Methoden für die chemische Analyse.
Zusammenfassung
Feedback
Melde uns Fehler und Verbesserungsvorschläge zur aktuellen Seite über dieses Formular. Vielen Dank ❤️
Footnotes
Credits Konduktometrische Messzelle. Grafik: Talos, Konduktometrie messzelle, CC BY-SA 3.0↩︎