Gleichgewichte
IMPP-Score: 0.6
Grundlagen zu Gleichgewichten und Aktivität in chemischen Systemen
Chemische Gleichgewichte sind grundlegend für das Verständnis verschiedenster chemischer Reaktionen und Prozesse. Sie finden überall dort statt, wo Reaktionen umkehrbar sind und sowohl die Reaktanten als auch die Produkte in einer dynamischen Balance stehen. Unerlässlich für das tiefe Verständnis ist das Konzept der Aktivität, der Gleichgewichtskonstanten und spezifischer, des Verteilungskoeffizienten, sowie der Löslichkeitsprodukte.
Das Massenwirkungsgesetz und Gleichgewichtskonstanten
Das Massenwirkungsgesetz (MWG) ist der Dreh- und Angelpunkt für das Verständnis chemischer Gleichgewichte. Es besagt, dass das Verhältnis der Produktkonzentrationen zur Potenz ihrer stöchiometrischen Koeffizienten dividiert durch das gleiche Verhältnis für die Reaktanten, bei konstanter Temperatur, eine konstante Größe ist. Diese Größe bezeichnet man als die Gleichgewichtskonstante \(K\). Für eine Reaktion der Form \(aA + bB \leftrightarrow cC + dD\) lautet das MWG:
\[K = \frac{[C]^c [D]^d}{[A]^a [B]^b}\]
Das IMPP fragt besonders gerne nach der Anwendung des Massenwirkungsgesetzes auf spezifische Gleichgewichte wie Säure-Base- und Redoxreaktionen sowie die Berechnung und Bedeutung des Verteilungskoeffizienten und Löslichkeitsproduktes.
Säure-Base-Gleichgewichte und pK-Werte
Bei Säure-Base-Reaktionen spielt das Verhältnis der Stärken von Säuren und Basen eine entscheidende Rolle. Dieses Verhältnis wird über pK-Werte ausgedrückt - konkret den pKa für Säuren und pKb für Basen. Diese Werte ermöglichen es uns, Vorhersagen über den Ausgang einer Säure-Base-Reaktion zu treffen. Die Beziehung zwischen pKa und pKb ist durch die Gleichung \(pKa + pKb = 14\) bei 25 °C gegeben.
Redoxreaktionen und ihre Gleichgewichtskonstante
Für Redoxreaktionen, also Reaktionen, bei denen Elektronen zwischen den Reaktanten übertragen werden, lässt sich die Gleichgewichtskonstante mit Hilfe des Standardreduktionspotentials (\(E^0\)) und der Anzahl der ausgetauschten Elektronen (\(n\)) berechnen. Die Formel lautet:
\[\log K = (\frac{n}{0,059}) \cdot E^0\]
Hierbei gibt \(E^0\) die Potenzialdifferenz zwischen den Redoxpaaren unter Standardbedingungen an. Dieses Verhältnis zeigt, wie stark eine Substanz oxidierend oder reduzierend wirkt.
Verteilungsgleichgewichte und Verteilungskoeffizienten
Bei der Verteilung eines Stoffes zwischen zwei nicht mischbaren Phasen spricht man von einem Verteilungsgleichgewicht. Der Verteilungskoeffizient \(K\) beschreibt das Verhältnis der Konzentrationen einer Substanz in diesen beiden Phasen und ist ein Maß dafür, wie sich eine Substanz bevorzugt in einer der beiden Phasen anreichert. Er ist entscheidend für die Planung und Auswertung von Extraktionen.
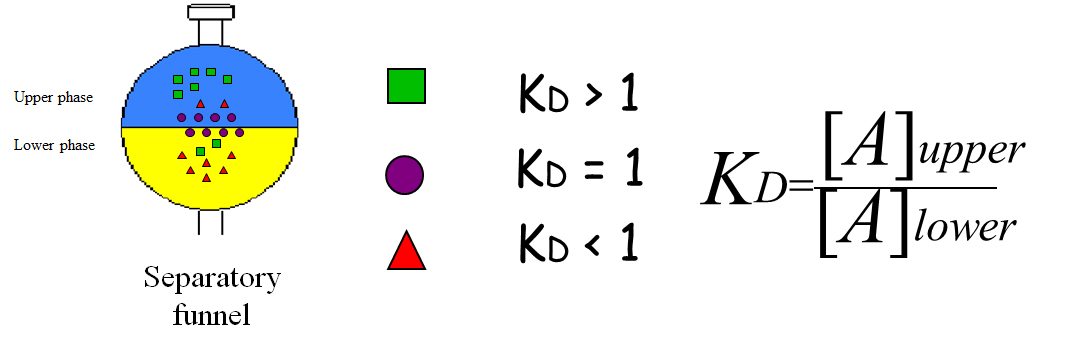
Beim Verteilungskoeffizienten \(K\) ist es wichtig zu beachten, dass sich dieser immer auf das Gleichgewicht zweier bestimmter Phasen bezieht und temperaturabhängig ist.
Zusammenfassung
Feedback
Melde uns Fehler und Verbesserungsvorschläge zur aktuellen Seite über dieses Formular. Vielen Dank ❤️
Footnotes
Credits Verteilungsgleichgewicht Grafik: Perdula, Partitioning coefficient (Kd), CC BY-SA 3.0↩︎
