Löslichkeit
IMPP-Score: 0.5
Löslichkeitsprodukt und Löslichkeit schwerlöslicher Salze
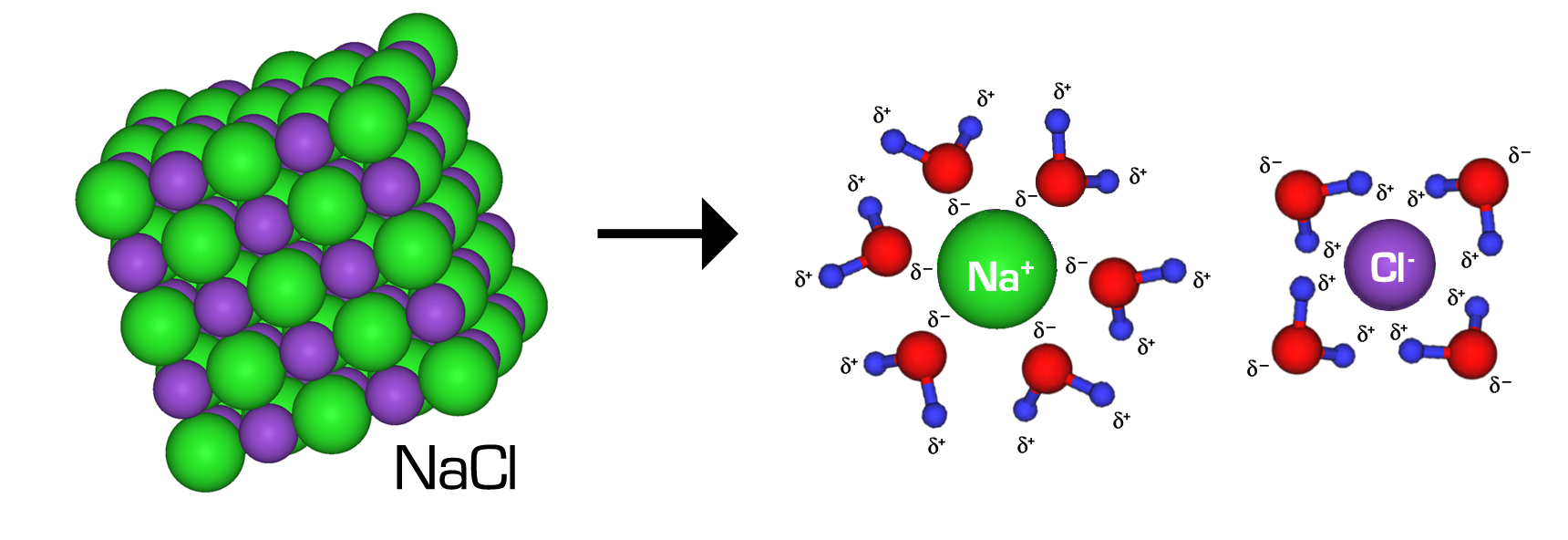
Was ist das Löslichkeitsprodukt?
Das Löslichkeitsprodukt (Lp) ist ein zentraler Begriff, wenn es darum geht, die Löslichkeit von schwerlöslichen Salzen in Wasser zu beschreiben. Es repräsentiert das Produkt der Ionenkonzentrationen, die ein Salz im Sättigungszustand einer Lösung erreicht. Es ist wichtig zu verstehen, dass das Löslichkeitsprodukt nicht direkt die Menge des gelösten Salzes angibt, sondern ein Gleichgewichtswert ist, der angibt, wann eine Lösung mit einem bestimmten Salz gesättigt ist.
Das Löslichkeitsprodukt ist ein Indikator dafür, ab wann keine weiteren Salzionen mehr in Lösung gehen.
Berechnung der Löslichkeit aus dem Löslichkeitsprodukt
Die molare Löslichkeit eines Salzes, das in einem Verhältnis von 1:1 Ionen dissoziiert, kann direkt aus dem Löslichkeitsprodukt ermittelt werden, indem man die Wurzel aus dem Löslichkeitsprodukt zieht.
Für ein Salz wie AgCl, dessen Lp \(1.8 \times 10^{-10} \, \text{mol}^2/\text{L}^2\) beträgt, berechnen wir die molare Löslichkeit (S) so:
\[S = \sqrt{Lp} = \sqrt{1.8 \times 10^{-10} \, \text{mol}^2/\text{L}^2} = 1.34 \times 10^{-5} \, \text{mol}/\text{L}\]
Das bedeutet, dass bei Erreichen des Sättigungspunktes 1.34 x 10^-5 Mol von AgCl pro Liter Lösung gelöst sind.
Einfluss von Fremdionen auf die Löslichkeit
Die Präsenz von Fremdionen in einer Lösung kann die Löslichkeit eines schwerlöslichen Salzes signifikant beeinflussen. Dieses Phänomen wird oft im Zusammenhang mit dem gemeinsamen Ioneneffekt diskutiert, kann aber auch anders betrachtet werden. Wenn Fremdionen hinzugefügt werden, die nicht mit dem schwerlöslichen Salz reagieren, kann dies zu einer Erhöhung der gesamten Ionenstärke der Lösung führen. Dies verringert die Aktivität der gelösten Ionen und kann die Löslichkeit des schwerlöslichen Salzes erhöhen.
Praktisches Beispiel zum Einfluss von Fremdionen
Betrachten wir das schwerlösliche Salz AgCl und die Wirkung der Zugabe von NaNO3 (welches Na+ und NO3^- als Fremdionen in die Lösung bringt). Die Zugabe von NaNO3 erhöht die gesamte Ionenstärke der Lösung, was wiederum dazu führen kann, dass AgCl eine höhere Löslichkeit erreicht als in reinem Wasser.
Das IMPP fragt besonders gerne nach der Berechnung der Löslichkeit aus dem Löslichkeitsprodukt und den Effekten von Fremdionen auf die Löslichkeit schwerlöslicher Salze. Stellt sicher, dass ihr beides verstanden habt!
Zusammenfassung
Feedback
Melde uns Fehler und Verbesserungsvorschläge zur aktuellen Seite über dieses Formular. Vielen Dank ❤️
Footnotes
Credits Lösungsvorgang Grafik: Ahazard.sciencewriter, NaCl dissolving, CC BY-SA 4.0↩︎
