Atomaufbau, Atommodelle und Quantenzahlen
IMPP-Score: 1.6
Atomaufbau: Protonen, Neutronen und Elektronen
Der Atomaufbau ist das Fundament der Chemie, und ein grundlegendes Verständnis des Zusammenspiels der subatomaren Partikel Protonen, Neutronen und Elektronen ist entscheidend. Im Folgenden gehen wir darauf ein, wie diese Partikel das Atom formen und welche Eigenschaften sie haben.

Protonen
Protonen sind positiv geladene Partikel im Atomkern. Ihre Anzahl bestimmt die Kernladungszahl, die wiederum angibt, um welches chemische Element es sich handelt. Ein neutrales Atom hat stets genauso viele Protonen wie Elektronen. Bei Blei (Pb) zum Beispiel weist die Ordnungszahl 82 darauf hin, dass ein neutrales Bleiatom genau 82 Protonen und damit auch 82 Elektronen enthält.
Die Kernladungszahl entspricht immer der Anzahl der Protonen im Atomkern – sie ist damit auch identisch mit der Anzahl der Elektronen im ungeladenen Atom.
Neutronen
Neutronen sind, wie die Name schon andeutet, neutral – sie besitzen keine elektrische Ladung. Sie befinden sich ebenfalls im Atomkern und tragen zur Atommasse bei, beeinflussen aber nicht die chemischen Eigenschaften eines Elements direkt. Ihre Anzahl kann variieren, was zur Entstehung verschiedener Isotope eines Elements führt. Die Massenzahl eines Atoms, zum Beispiel Brom-79, ist die Summe aus Protonen und Neutronen. Um die Neutronenzahl zu ermitteln, subtrahiert man die Protonenzahl (Ordnungszahl) von der Massenzahl.
Die Massenzahl entspricht der Summe der Protonen und Neutronen. Um die Anzahl der Neutronen zu berechnen, subtrahiert man die Anzahl der Protonen von der Massenzahl.
Elektronen
Elektronen sind negativ geladene Partikel, die sich in der Elektronenhülle um den Atomkern bewegen. Sie sind wesentlich leichter als Protonen – ihre Masse beträgt etwa \(\frac{1}{1836}\) der Protonenmasse. Die Elektronen bestimmen die chemischen Eigenschaften eines Atoms durch ihre Anordnung in den verschiedenen Orbitalen.
Isoelektronische Ionen besitzen die gleiche Anzahl an Elektronen und ähneln sich deshalb in ihren Elektronenkonfigurationen, wobei sie sich auf die Edelgas-Konfiguration beziehen. Zum Beispiel hat ein Kaliumion (\(K^+\)) die gleiche Elektronenanzahl wie ein Argonatom und ist daher isoelektronisch zu Argon.
Überblick
Die wichtigsten Eigenschaften dieser Teilchen sind in der folgenden Tabelle zusammengefasst:
| Info | Protonen | Neutronen | Elektronen |
|---|---|---|---|
| Masse | \(1,673 \cdot 10^{-24} g\) | \(1,675 \cdot 10^{-24} g\) | \(0,911 \cdot 10^{-27} g\) |
| Elektrische Ladung | \(+ 1 e\) | \(0 e\) | \(- 1 e\) |
| Vorkommen | Kern | Kern | Elektronenhülle |
Bedeutung für das chemische Verhalten
Es ist essenziell zu verstehen, dass Atome durch den Austausch oder die gemeinsame Nutzung von Elektronen chemische Bindungen eingehen. Die Verteilung der Elektronen in den Orbitalen entscheidet darüber, wie ein Atom interagiert und Bindungen bildet. So streben Atome danach, eine stabile Elektronenkonfiguration zu erreichen, die oft der eines Edelgases gleicht.
Atommodelle und Quantenzahlen: Raum und Energie
Die Welt der Atommodelle und Quantenzahlen ist eine faszinierende, die es dir ermöglicht, die Architektur der Materie zu verstehen. Hast du dich jemals gefragt, warum Elemente so unterschiedliche Eigenschaften haben? Die Antwort liegt im Atomaufbau und den Energieniveaus der Elektronen.
Atombau und Kern-Hülle-Modell
Zunächst muss betont werden, dass der Atomkern, bestehend aus Protonen und Neutronen, extrem klein ist verglichen mit der Elektronenhülle. Dieses Konzept ist unglaublich wichtig, da es die Grundlage für das Kern-Hülle-Modell bildet. Der Atomkern konzentriert fast die gesamte Masse des Atoms auf sich, während die Elektronenhülle den größten Teil des** Raums** einnimmt.
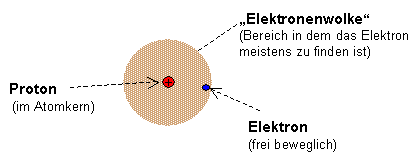
In der Grafik ist dieser Zusammenhang nochmal dargestellt, wobei die Neutronen im Kern ausgelassen wurden. Erinnerst du dich an das Rutherford’sche Modell? Es zeigte uns, dass der Kern sehr klein ist und eine positive Ladung hat – ein Meilenstein in der Entwicklung der Atomtheorie.
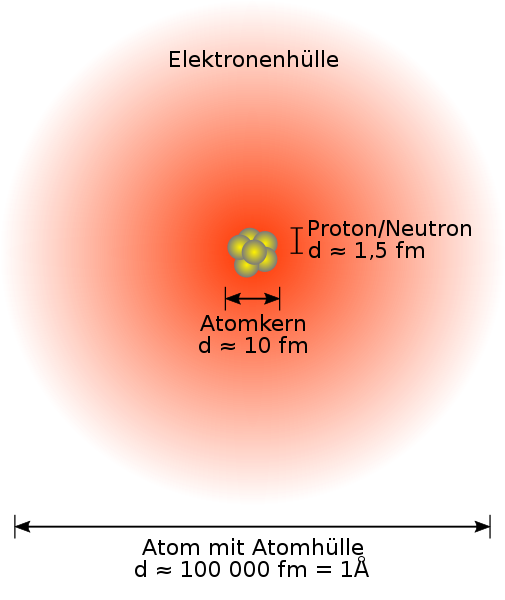
Die Größenverhältnisse (etwa 1:10 000) sind in der oben gezeigten Grafik dargestellt. Faktenwissen, was bereits abgefragt wurde.
Quantenzahlen
Jetzt kommen wir zum Kern dieses Themas: den Quantenzahlen und was sie bedeuten. Ein Elektron in einem Atom wird eindeutig durch vier Quantenzahlen beschrieben:
- Hauptquantenzahl (n): Definiert das Energieniveau und die Größe des Orbitals.
- Nebenquantenzahl (l): Bestimmt die Form des Orbitals.
- Magnetquantenzahl (ml): Beschreibt die räumliche Ausrichtung des Orbitals.
- Spinquantenzahl (ms): Gibt den Spin des Elektrons an.
Hier sind die Quantenzahlen und die möglichen Werte der jeweiligen Quantenzahl noch einmal in einer Tabelle zusammengefasst:
| Quantenzahl | Bedeutung | Werte |
|---|---|---|
| Hauptquantenzahl n | Energieniveau und Größe des Orbitals | \(n = 1, 2, 3, 4, ...\) |
| Nebenquantenzahl l | Form des Orbitals | \(l = 0, 1, 2, 3, ..., n-1\) |
| Magnetquantenzahl m | Räumliche Ausrichtung des Orbitals | \(m = -l, ...,0,...,+l\) |
| Spinquantenzahl s | Spinzustand des Elektrons | \(s = + 1/2 ~,~ - 1/2\) |
Das Orbitalmodell
Orbitale sind keine fest umrissenen Bahnen, sondern sind Gebiete im Raum um den Atomkern, wo die Elektronenaufenthaltswahrscheinlichkeit hoch ist. Die Form eines Orbitals wird durch die Nebenquantenzahl (l) definiert und durch die Magnetquantenzahl (ml) in den Raum ausgerichtet. Hierbei darfst du nicht vergessen, dass, je höher die Hauptquantenzahl (n), desto größer das Orbital und desto weiter weg befindet es sich vom Kern – die Energie steigt mit zunehmender Entfernung vom Kern.

Die Grafik veranschaulicht noch einmal die verschiedenen Orbitalformen.
Die Energie der Elektronen und ihre Zustände
Energiezustände der Elektronen sind essentiell, um zu verstehen, wie Elektronen sich verhalten, wenn sie Energie aufnehmen oder abgeben. Zum Beispiel ist es entscheidend zu wissen, dass Energiezufuhr dazu führt, dass Elektronen auf ein höheres Energieniveau angehoben werden. Dies hat große Auswirkungen auf die Chemie des Elements und seine Eigenschaften.
Orbitale und Elektronenkonfiguration
Die Elektronenkonfiguration eines Atoms ist die Verteilung der Elektronen über die verschiedenen verfügbaren Orbitale. Die Konfiguration hängt streng von den vier Quantenzahlen ab und folgt dem Pauli-Prinzip sowie der Hund’schen Regel, die besagt, dass Orbitale eines Sublevels erst einfach besetzt werden, bevor Elektronen gepaart werden. Diese Regeln bestimmen die chemischen und physikalischen Eigenschaften der Elemente.
Das IMPP fragt besonders gern nach diesen Details, also stell sicher, dass du die Konzepte hinter den Quantenzahlen und den Orbitalen verinnerlicht hast.
Die Formen der Orbitale (sphärisch, hantelförmig, etc.) und die Anzahl möglicher Orientierungen im Raum sind entscheidende Konzepte. Diese Informationen liefern dir direkt Hinweise auf das chemische Verhalten der Elemente.
Die Schlüsselkonzepte des Orbitalmodells
Abschließend solltest du die Schlüsselkonzepte immer im Hinterkopf behalten:
- Atomkern und Elektronenhülle sind in Größe und Masse stark unterschiedlich.
- Die vier Quantenzahlen geben uns einen detaillierten Einblick in den Energiezustand der Elektronen.
- Orbitale sind nicht einfach nur Bahnen, sie sind Räume, in denen die Wahrscheinlichkeit, ein Elektron zu finden, am höchsten ist.
- Elektronenkonfiguration und Energiezustände sind eng miteinander verknüpft und beeinflussen die Chemie des Elements.
Wenn du diese Konzepte verstehst, bist du auf dem besten Weg, das nächste Examen mit Bravour zu meistern!
Zusammenfassung
Feedback
Melde uns Fehler und Verbesserungsvorschläge zur aktuellen Seite über dieses Formular. Vielen Dank ❤️
Footnotes
Credits Elementarteilchen Grafik: Christinelmiller, Subatomic Attitude, CC BY-SA 4.0↩︎
Credits Atombau Grafik: Daniel B / Lanzi, Atombau, CC BY-SA 3.0↩︎
Credits Größenverhältnisse im Atom Grafik: I, Cweiske, Atom-schematic de, CC BY-SA 3.0↩︎
Credits Orbitalformen Grafik: haade, Single electron orbitals, CC BY-SA 3.0↩︎
