Systeme
IMPP-Score: 0.7
Systeme in der Thermodynamik: Definitionen, Eigenschaften und Prozesse
Einleitung
In der Thermodynamik beschäftigen wir uns mit Systemen, die auf unterschiedliche Weise Materie und Energie mit ihrer Umgebung austauschen können. Unterteilt werden diese Systeme in offene, geschlossene und isolierte Systeme. Jeder dieser Typen spielt in der chemischen und physikalischen Welt eine entscheidende Rolle und ist in unzähligen Prozessen präsent - von den Zellen in unserem Körper bis hin zu großtechnischen Produktionsanlagen.
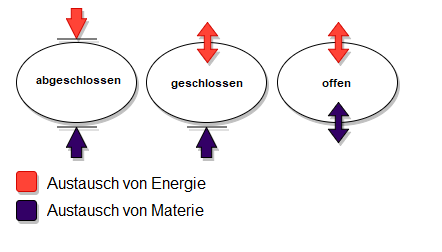
Die oben gezeigte Grafik gibt uns einen Überblick über die verschiedenen thermodynamischen Systeme.
Offene Systeme
Offene Systeme sind durch die Fähigkeit charakterisiert, sowohl Materie als auch Energie mit ihrer Umgebung auszutauschen. Ein klassisches Beispiel ist eine biologische Zelle, die Nährstoffe aufnimmt und Abfallprodukte abgibt, während sie gleichzeitig Energie in Form von Wärme mit ihrer Umgebung austauscht. In offenen Systemen können sich sogenannte Fließgleichgewichte einstellen, in denen die Geschwindigkeit der hinein- und herausströmenden Materie und Energie so perfekt ausbalanciert ist, dass sich die Zusammensetzung des Systems nicht verändert.

Dabei kann ein Fließgleichgewicht in einem chemischen Reaktor als ein dynamischer Gleichgewichtszustand betrachtet werden, bei dem Reaktionsgeschwindigkeiten und das Verhältnis von Ausgangsstoffen zu Produkten konstant bleiben, obwohl Reaktionen kontinuierlich ablaufen.
Das IMPP fragt besonders gerne nach Fließgleichgewichten und ihrer Bedeutung in offenen Systemen.
Geschlossene Systeme
Geschlossene Systeme erlauben den Austausch von Energie, aber nicht von Materie mit der Umgebung. Beispiele hierfür wären Druckbehälter, in denen chemische Reaktionen ablaufen. In diesen Systemen sind Zustandsgrößen wie Innere Energie, Druck und Volumen extrem wichtig, weil sie über den Energieaustausch mit der Umgebung (Arbeit und Wärme) bestimmen. Bei einem geschlossenen Reaktionssystem bleibt die Masse der Reaktanden gleich, unabhängig davon, wie sie miteinander reagieren. Der Born-Haber-Kreisprozess ist ein hypothetisches Beispiel, bei dem verschiedene Zustandsfunktionen genutzt werden, um thermodynamische Größen wie Gitterenergien von Ionenverbindungen abzuleiten.

Der Zustand eines geschlossenen Systems wird durch Zustandsgrößen beschrieben, die auch die Änderung von Energieformen wie Wärme und Arbeit erfassen.
Isolierte oder abgeschlossene Systeme
Isolierte Systeme sind komplett von der Umgebung abgegrenzt, d.h. sie erlauben weder Materie- noch Energieaustausch. Hierzu zählt das ideale Dewar-Gefäß für den Laborgebrauch, das thermisch isoliert ist und somit einen adiabatischen Prozess ermöglicht. In einem ideal isolierten System bleibt die innere Energie konstant. Betrachten wir die Entropie, ist sie in einem wirklich isolierten System maximal und kann nicht weiter zunehmen, da kein Energieaustausch stattfindet.

Das IMPP kann Fragen zu adiabatischen Prozessen und isolierten Systemen stellen, da dies grundlegende Prinzipien der Thermodynamik sind.
Zusammenfassung
Feedback
Melde uns Fehler und Verbesserungsvorschläge zur aktuellen Seite über dieses Formular. Vielen Dank ❤️
Footnotes
Credits Die verschiedenen thermodynamischen Systeme Grafik: Alkh.Alwa, Diagram Systems, bearbeitet von MK, CC BY-SA 4.0↩︎
Credits Beispiel für ein offenes System Grafik: TimJW12, Trifluoroacetic acid in a beaker, CC BY-SA 4.0↩︎
Credits Beispiel für ein geschlossenes System Grafik: Anonymous. Rainer Zenz assumed (based on copyright claims)., Normflasche-1, CC BY-SA 3.0↩︎
Credits Beispiel für ein abgeschlossenes/isoliertes System Grafik: User:Dhscommtech, Thermos, CC BY-SA 3.0>↩︎
