Reaktions-Energie-Diagramme
IMPP-Score: 0.5
Reaktionskoordinate und Reaktionsverlauf
Stell dir eine Reaktionskoordinate vor wie die Route eines Bergsteigers, der einen Berg überwinden muss, um von Punkt A nach Punkt B zu gelangen. Hier sind Punkt A die Reaktanten und Punkt B die Produkte. Die Höhe des Berges repräsentiert die potentielle Energie, die während der Reaktion überwunden werden muss. Auf dieser metaphorischen Wanderung erklimmst du Gipfel und durchschreitest Täler – in einem Reaktionsenergiediagramm entsprechen diese den Übergangszuständen und Zwischenprodukten.
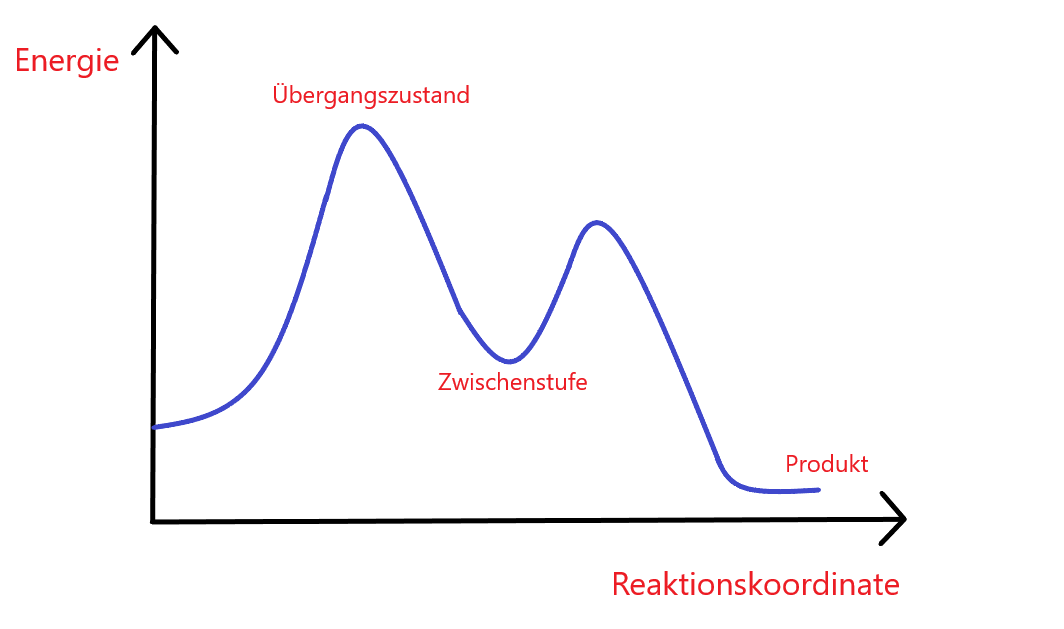
Exotherme Reaktionen führen von einem höheren zu einem niedrigeren Energieniveau. Analog dazu ist es, als würde der Bergsteiger einen Berg hinuntersteigen und dabei Energie freisetzen. Bei endothermen Reaktionen steigt das Energieniveau – hier erklimmt der Bergsteiger den Gipfel und benötigt dafür zusätzliche Energie.
Gleichgewichtszustände in einem Energieprofil zeigen, wo die Energie der Produkte und Reaktanten gleich ist. Das IMPP fragt besonders gerne nach diesen Punkten und deren Relevanz für Hin- und Rückreaktion.
Aktivierungsenergie und freie Aktivierungsenthalpie
Die Aktivierungsenergie (\(E_a\)) ist wie der steilste Teil der Wanderung des Bergsteigers. Je höher der Steilhang, desto mehr Energie ist notwendig, um ihn zu überwinden. Diese Energiebarriere bestimmt, wie schnell eine Reaktion stattfinden kann, da Teilchen genügend Energie besitzen müssen, um den Übergangszustand zu erreichen.
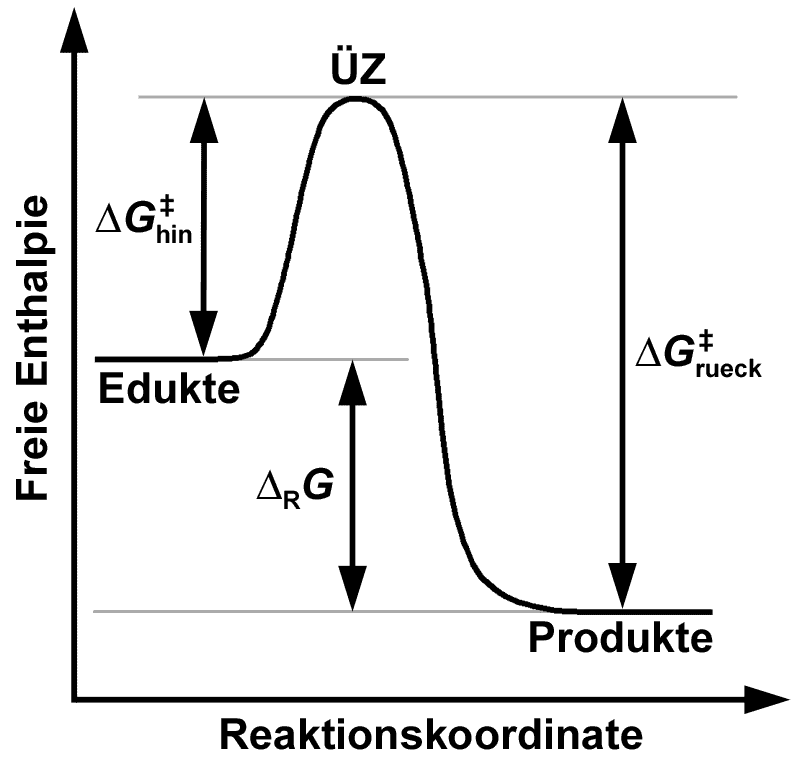
Die freie Aktivierungsenthalpie (\(\Delta G^\ddagger\)) ist ein Maß für die Energie, die notwendig ist, damit eine Reaktion unter gegebenen Bedingungen eintreten kann. Sie beinhaltet neben der Energie (Enthalpie \(H\)) auch die Temperatur und die Entropieänderung (\(\Delta S^\ddagger\)) des Systems. Daher ist die Betrachtung von \(\Delta G\) gegenüber \(E_a\) vorteilhaft, da sie ein umfassenderes Bild der Reaktionsbedingungen liefert.
Die Höhe der Aktivierungsbarriere in einem Reaktionsenergiediagramm zeigt, ob eine Reaktion kinetisch oder thermodynamisch kontrolliert ist. Für das IMPP ist die Unterscheidung von kinetischer und thermodynamischer Kontrolle ein beliebtes Prüfungsthema.
Übergangszustand und Zwischenprodukte
Der Übergangszustand ist der Gipfel, den der Bergsteiger erreichen muss, und das lokale Maximum in einem Energieprofil. Es ist der Punkt, an dem die Reaktanten in Produkte umgewandelt werden. Zwischenprodukte sind dagegen wie Rastplätze – lokale Minima im Energieverlauf, wo die Reaktion pausieren kann.
Der Schritt mit der höchsten Aktivierungsenergie wird als geschwindigkeitsbestimmender Schritt definiert. Er ist der Schlüsselmoment des gesamten Prozesses, ähnlich dem steilsten und mühsamsten Teil der Bergwanderung. Dieser Schritt limitiert das Gesamttempo der Reaktionssequenz.
Hammond-Postulat und Potentialhyperfläche
Das Hammond-Postulat hilft uns, die Beziehung des Übergangszustands zu den Reaktanten und Produkten zu verstehen. Bei exothermen Reaktionen ähnelt der Übergangszustand den Reaktanten, da er eher früh auf der Reaktionskoordinate erscheint, und bei endothermen Reaktionen ähnelt er den Produkten.
Die Potentialhyperfläche ist eine visualisierte Landschaft aller möglichen Übergangszustände und Energieverläufe. Sie ist wesentlich komplexer als das eindimensionale Reaktionsenergiediagramm und bietet tiefere Einblicke in die dynamischen Reaktionswege, insbesondere bei komplexen, mehrstufigen Reaktionen.
Denke stets daran, dass in der Chemie der kürzeste Pfad zwischen zwei Punkten nicht immer der direkteste ist – im Kontext von Reaktionen bedeutet dies, dass der energetisch günstigste Reaktionsweg oft durch Zwischenprodukte und verschiedene Übergangszustände führt.
Zusammenfassung
Feedback
Melde uns Fehler und Verbesserungsvorschläge zur aktuellen Seite über dieses Formular. Vielen Dank ❤️
Footnotes
Credits Reaktionsdiagramm Grafik: Autor unbekannt.↩︎
Credits Enthalpie in Abhängigkeit der Reaktionskoordinate Grafik: Espresso robusta, Aktivierungsenergie, CC BY-SA 4.0↩︎
