Periodische Eigenschaften
IMPP-Score: 1.2
Periodische Eigenschaften im Periodensystem
Die periodischen Eigenschaften sind entscheidend für das Verständnis des chemischen Verhaltens der Elemente. Sie erlauben es uns, Voraussagen darüber zu treffen, wie sich Atome in Verbindungen verhalten werden. Die Eigenschaften der Elemente ändern sich vorhersagbar über das PSE. Schauen wir uns diese Eigenschaften und ihre Zusammenhänge genauer an.
Atom- und Ionenradien
Beginnen wir mit den Atom- und Ionenradien. Der Atomradius beschreibt die Größe eines neutralen Atoms und nimmt innerhalb einer Periode von links nach rechts aufgrund der steigenden effektiven Kernladung ab. Das bedeutet, dass mit jedem hinzugefügten Proton im Kern und dem entsprechenden Elektron in der Schale die Anziehung auf die Elektronenwolke stärker wird und das Atom sich zusammenzieht.

Innerhalb einer Gruppe nimmt der Atomradius von oben nach unten zu, da mit jeder Periode eine zusätzliche Elektronenschale hinzukommt, wodurch die Elektronen weiter vom Kern entfernt sind.
Nicht nur die Größe von Atomen, sondern auch von Ionen ist essentiell, um zu verstehen, wie chemische Verbindungen gebildet und gebrochen werden.
Die Ionenradien zeigen ähnliche Trends wie die Atomradien, jedoch kommt noch ein weiterer Aspekt ins Spiel. Kationen (positiv geladene Ionen) sind kleiner als ihre neutralen Atome, weil sie Elektronen verloren haben und die effektive Kernladung relativ zu den verbleibenden Elektronen gestiegen ist. Anionen (negativ geladene Ionen) hingegen sind größer, da durch das zusätzliche Elektron die elektrostatische Abstoßung zwischen den Elektronen steigt, was zu einer Ausdehnung der Elektronenwolke führt.
Bei isoelektronischen Ionen – also Ionen mit der gleichen Elektronenanzahl, aber unterschiedlicher Kernladung – wird der Ionenradius durch die Anzahl der Protonen im Kern beeinflusst. Mit zunehmender Kernladung verringert sich der Ionenradius, auch wenn die Anzahl der Elektronen gleich bleibt. Das ist eine häufig gefragte Prüfungsfrage vom IMPP.
Elektronegativität
Die Elektronegativität ist ein Maß dafür, wie stark Atome in einer chemischen Bindung Elektronen anziehen. Sie nimmt im Periodensystem von links nach rechts zu und von oben nach unten ab. Fluor beispielsweise, als das Element mit der höchsten Elektronegativität, zieht Elektronen stärker an als Iod.
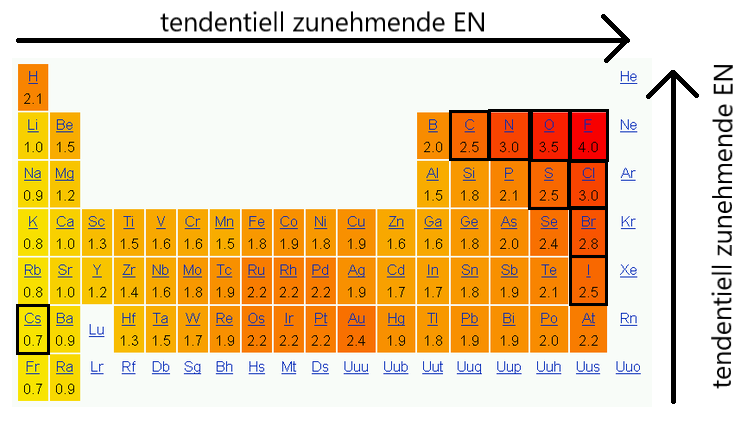
Es gibt verschiedene Skalen zur Messung der Elektronegativität, wie die von Pauling, Mulliken und Rochow. Diese Skalen sind nützlich, um die relative Tendenz von Atomen zu vergleichen, Elektronen anzuziehen.
Die Elektronegativität ist ein Schlüsselkonzept beim Verständnis von Bindungsarten und Reaktivität von Elementen.
Ionisierungsenergie und Elektronenaffinität
Ionisierungsenergie ist die Energie, die benötigt wird, um ein Elektron vollständig von einem Atom oder Ion zu entfernen. Innerhalb einer Periode steigt die Ionisierungsenergie von links nach rechts an, während sie innerhalb einer Gruppe von oben nach unten abnimmt. Dies liegt an der Abnahme des Atomradius und dem Anstieg der effektiven Kernladung entlang einer Periode sowie der Zunahme des Atomradius und der dadurch bedingten Abschwächung der Kernbindung entlang einer Gruppe.
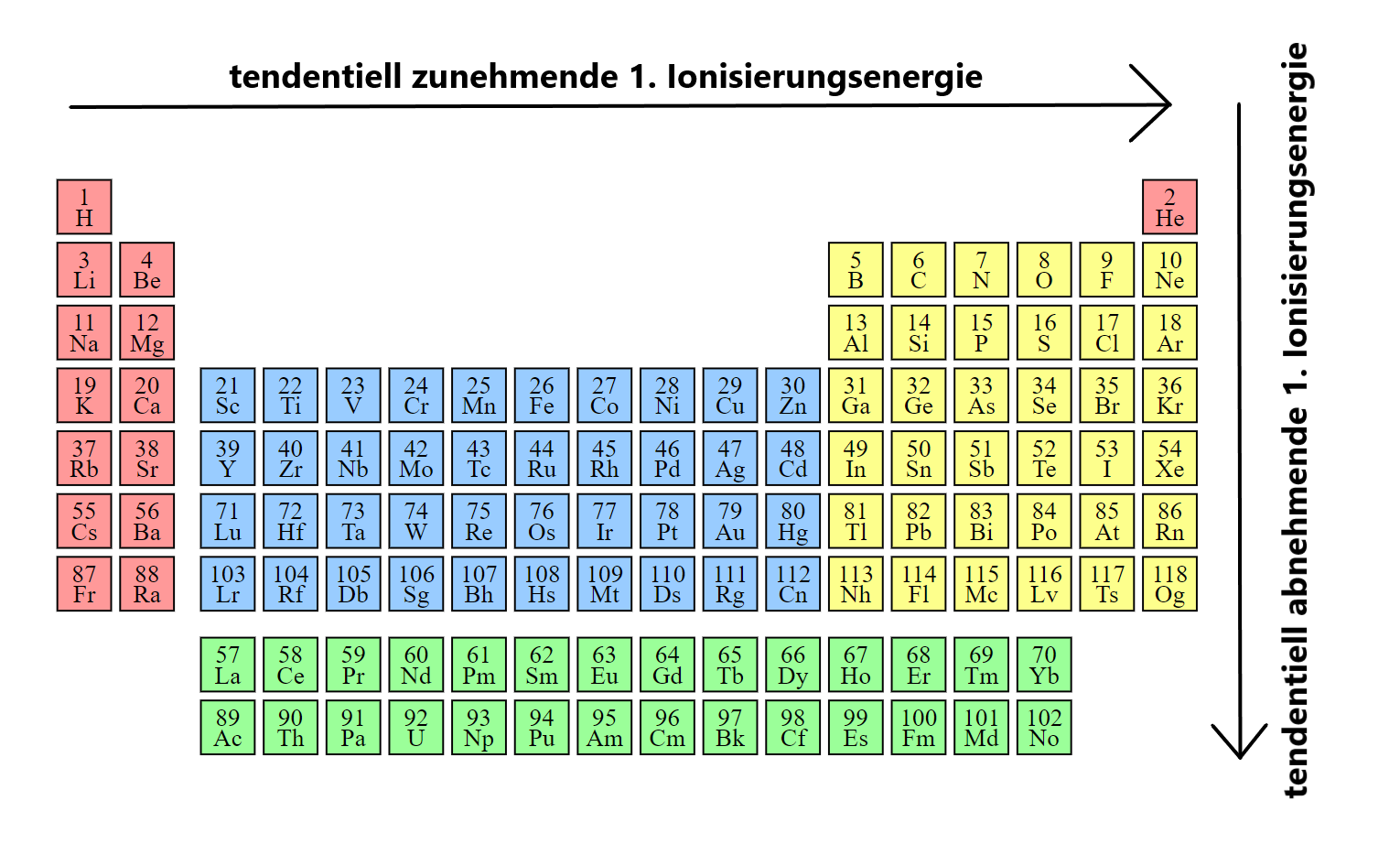
Die Elektronenaffinität hingegen gibt an, wie viel Energie freigesetzt oder aufgenommen wird, wenn ein Atom ein Elektron aufnimmt. Elemente mit hoher Elektronegativität neigen dazu, eine hohe Elektronenaffinität zu besitzen.
Es ist hilfreich, sich Ionisierungsenergien wie ein Maß für die „Stärke“ der Anziehung zwischen dem Atomkern und dem Elektron vorzustellen. Je stärker die Anziehung, desto mehr Energie wird benötigt, um das Elektron zu entfernen.
Oxidationszahlen und Standardpotentiale
Die Oxidationszahl spiegelt die hypothetische Ladung wider, welche ein Atom haben würde, wenn die Bindungen als ionisch angenommen werden. Das Wissen um Oxidationszahlen ist für das Verständnis von Redoxreaktionen unerlässlich.
Standalonelektrodenpotentiale zeigen die Tendenz eines Redoxpaares an, Elektronen aufzunehmen (Reduktion) oder abzugeben (Oxidation), gemessen gegen eine Standard-Wasserstoffelektrode. Es sind diese Potentiale, die uns sagen, ob eine Substanz ein guter Oxidator oder Reduktor ist – ein weiteres beliebtes Prüfungsthema.
Die Kenntnis von Oxidationszahlen und Elektrodenpotentialen ist entscheidend für das tiefe Verständnis von Redoxreaktionen.
Nutzung der periodischen Eigenschaften
Die Kenntnis dieser periodischen Eigenschaften ermöglicht es uns, chemische Reaktionen vorherzusagen und zu verstehen, warum bestimmte Reaktionen so ablaufen, wie sie es tun. Die Neigung von Atomen, Elektronen in Bindungen anzuziehen, hängt von ihrer Elektronegativität ab. Die Stärke von oxidierenden und reduzierenden Agenten ist durch ihre Standardpotentiale bestimmt.
Das IMPP fragt besonders gerne nach den periodischen Trends wie Atomradien und Elektronegativität, also stelle sicher, dass du diese Konzepte gut verstanden hast.
Schrägbeziehungen
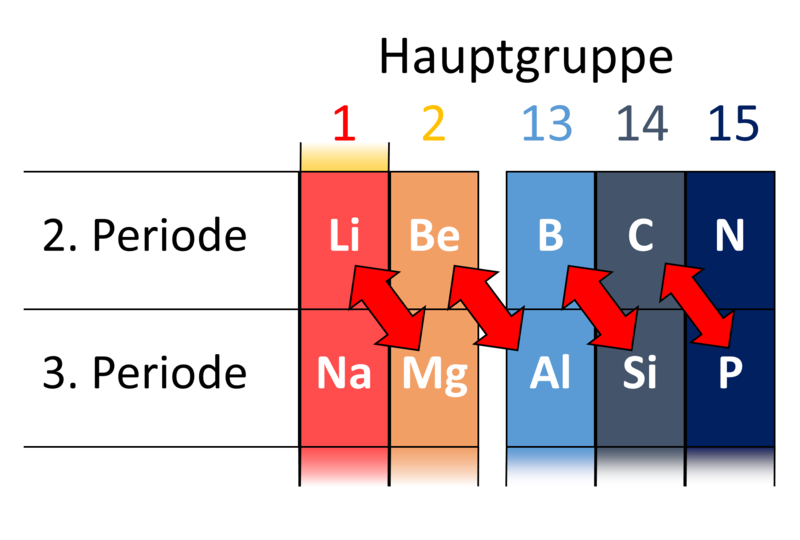
Die Schrägbeziehung beschreibt eine interessante Eigenschaft des PSE: Elemente, die sich in aufeinanderfolgenden Gruppen und Perioden befinden, haben oft ähnliche Eigenschaften. Ein klassisches Beispiel ist das Paar Lithium (Li) und Magnesium (Mg), welche sich jeweils in der ersten bzw. zweiten Hauptgruppe befinden. Beryllium und Aluminium gehören ebenfalls dazu.
Jedes einzelne dieser Konzepte beeinflusst, wie Atome interagieren und Verbindungen bilden. Das Verständnis wie Atomgröße, Ladung, Elektronegativität und Elektrodenpotentiale zusammenwirken, ist ausschlaggebend, um die vielfältige Welt der Chemie zu entschlüsseln.
Das Erkennen von Schrägbeziehungen hilft, unerwartete Ähnlichkeiten im chemischen Verhalten von Elementen zu erklären.
Zusammenfassung
Feedback
Melde uns Fehler und Verbesserungsvorschläge zur aktuellen Seite über dieses Formular. Vielen Dank ❤️
Footnotes
Credits Atomradientrends im PSE Grafik: Bleckneuhaus, CC BY-SA 3.0, via Wikimedia Commons↩︎
Credits Elektronegativitätstrends im PSE Grafik: Joanjoc at Catalan Wikipedia, Taula periòdica electronegativitat, marked as public domain, more details on Wikimedia Commons↩︎
Credits Ionisierungsenergietrends im PSE Grafik: User:Double sharp, modified by MK based on File:Simple Periodic Table Chart-en.svg by User:Offnfopt, Simple Periodic Table Chart-blocks, CC BY-SA 4.0↩︎
Credits Schrägbeziehungen im PSE Grafik: HeManLeser, Schrägbeziehung, CC BY-SA 4.0↩︎
