Aminosäuren, Peptide und Proteine
IMPP-Score: 3.7
Proteinogene Aminosäuren und ihre Eigenschaften
Die proteinogenen Aminosäuren sind die Bausteine der Proteine, die in den Zellen lebender Organismen vorkommen. Es gibt 20 solcher Aminosäuren, die in der menschlichen Biologie eine Rolle spielen. Jede dieser Aminosäuren verfügt über eine einzigartige Seitenkette, die bestimmt, wie sie interagieren und welche Struktur das Protein annimmt, das sie bilden.
Struktur und Eigenschaften
Die allgemeine Struktur einer proteinogenen Aminosäure besteht aus einem zentralen α-Kohlenstoffatom, an dem eine Carboxylgruppe (-COOH), eine Aminogruppe (-NH2), ein Wasserstoffatom und eine variable Seitenkette (der sogenannte R-Rest) gebunden sind. Diese Seitenkette ist es, die jeder Aminosäure ihre einzigartige Identität verleiht.
Die Aminosäuren werden oft anhand ihrer chemischen Natur kategorisiert – polar, unpolar, basisch oder sauer – was wiederum ihre Wechselwirkungen und Funktionen innerhalb eines Proteins beeinflusst.
Die Seitenketten der proteinogenen Aminosäuren bestimmen ihre Eigenschaften und ihre Funktion in Proteinen.
Wichtige Aminosäuren und ihre Seitenketten
- Lysin weist eine lange, aliphatische Seitenkette auf, die am Ende eine ε-Aminogruppe trägt. Es ist wichtig, den pKs-Wert dieser Gruppe zu beachten, da er die basischen Eigenschaften von Lysin mitbestimmt. Bei einem isoelektrischen Punkt (pI) von etwa 9.6 liegt Lysin bei physiologischem pH-Wert positiv geladen vor.
- Bei Histidin sorgt der Imidazolring für besondere Eigenschaften. Der pKs-Wert seines Seitenkettenstickstoffs liegt nahe am neutralen pH und ermöglicht es Histidin, in enzymatischen Reaktionen als Protonenpuffer zu agieren.
- Tyrosin besitzt einen Phenolring in seiner Seitenkette, was seine polaren Eigenschaften verstärkt und seine Rolle bei Protein-Protein-Interaktionen erklärt.
- Einzigartig unter den Aminosäuren ist Prolin mit seinem pyrrolidinischen Ring, der die Flexibilität der Peptidkette einschränkt und die Struktur von Proteinen beeinflusst.
Das IMPP fragt besonders gerne nach den Eigenschaften und den pKs-Werten der Seitenketten, also stellt sicher, dass ihr sie für die proteinogenen Aminosäuren grob abschätzen könnt.
Isoelektrischer Punkt
Für die Berechnung des isoelektrischen Punkts müssen bei Aminosäuren wie Lysin die pKs-Werte der beteiligten ionisierbaren Gruppen betrachtet werden. Der isoelektrische Punkt ist der pH-Wert, bei dem eine Aminosäure keine Nettoladung aufweist. Dies ist insbesondere für den Umgang mit Proteinen und Aminosäuren bei der Elektrophorese und anderen analytischen Methoden von Bedeutung.
Einfluss der Seitenketten
Nehmen wir das Beispiel von Valin und Isoleucin: Diese Aminosäuren gehören zu einer homologen Reihe und unterscheiden sich nur durch eine zusätzliche Methylengruppe (CH2) in der Seitenkette von Isoleucin. Diese scheinbar kleine Veränderung beeinflusst ihre metabolischen Pfade und wie sie in Proteinstrukturen eingebaut werden.
Titration und pKs-Werte
Bei der Titration von Aminosäuren lassen sich die pKs-Werte durch Beobachtung der Änderungen in der Protonierung über den pH-Bereich ermitteln. Die pKs-Werte sind ein Indiz dafür, wie stark oder schwach die entsprechenden Gruppen der Aminosäuren als Säuren agieren. Diese Werte geben uns auch wichtige Hinweise auf das Säure-Base-Verhalten von Aminosäuren in wässrigen Lösungen und sind entscheidend für die Berechnung der isoelektrischen Punkte.
Die Kenntnis der pKs-Werte und wie sie den isoelektrischen Punkt (pI) beeinflussen, ist essentiell für das Verständnis der Aminosäurechemie.
Peptidbindungen, Aufbau und Struktur von Peptiden und Proteinen
Peptide und Proteine sind zentrale Moleküle in der Biochemie und bestehen aus Aminosäuren, welche durch Peptidbindungen verknüpft sind. Um diese Thematik wirklich zu verstehen, ist es wichtig, die Details der Peptidbindung sowie die Struktur dieser Biomoleküle zu betrachten.
Peptidbindungen
Die Peptidbindung entsteht durch eine Kondensationsreaktion, bei der die Carboxylgruppe einer Aminosäure mit der Aminogruppe einer anderen Aminosäure unter Abspaltung von Wasser reagiert. Diese Bindung ist eine Amidbindung, welche eine partielle Doppelbindungscharakter aufweist. Dies resultiert aus der Mesomeriestabilisierung; die Elektronen des Stickstoffs können sich über das Carbonylkohlenstoffatom delokalisieren. Ein konsequenter Effekt daraus ist, dass die durch die Peptidbindung verbundenen Atome in einer Ebene angeordnet sind.
Die Peptidbindung ist planar und hat partiellen Doppelbindungscharakter, was die Rotation um diese Bindung einschränkt und die räumliche Anordnung der Aminosäuren in den Proteinen beeinflusst.
Aufbau von Peptiden und Proteinen
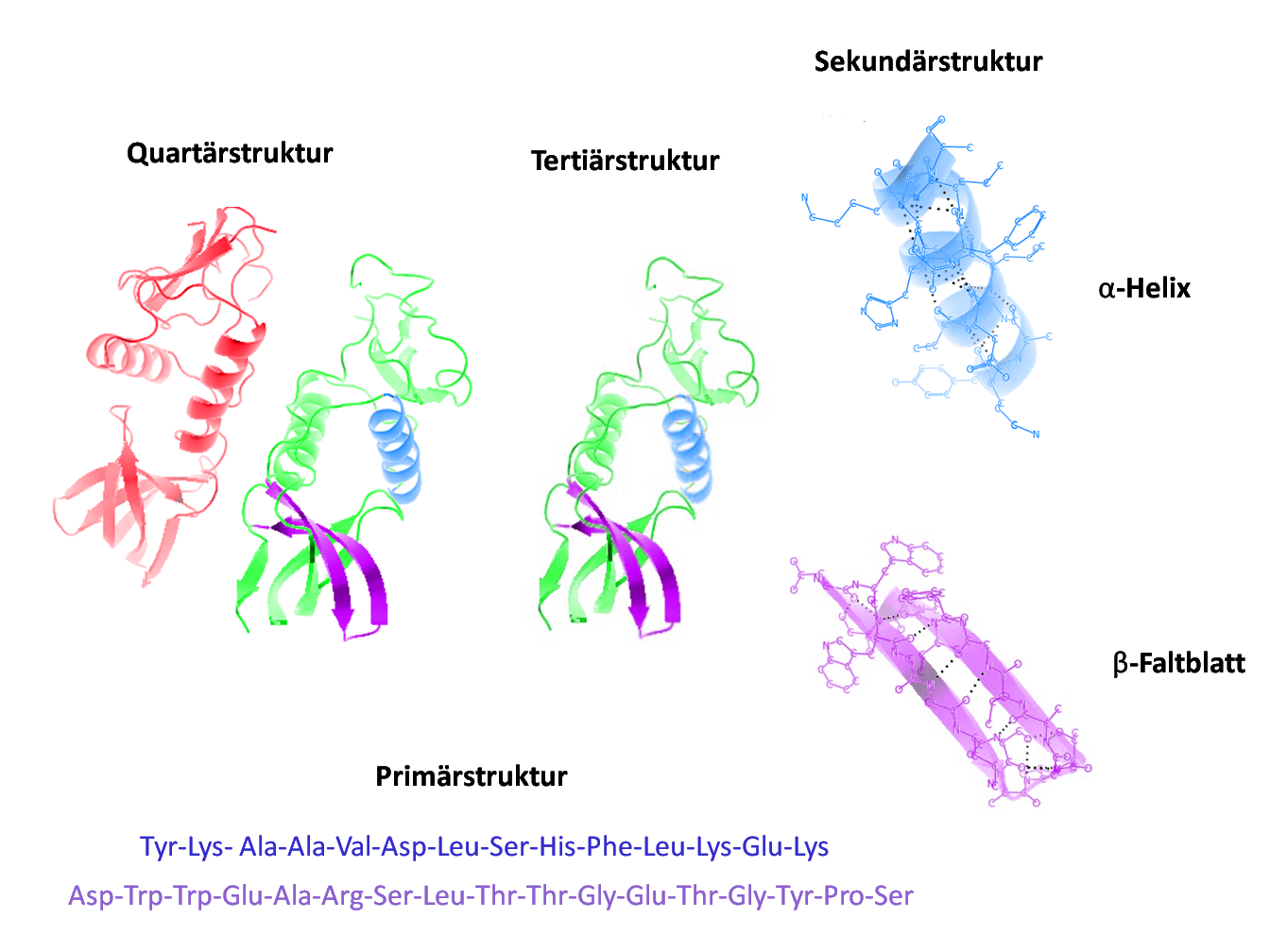
Primärstruktur
Die Primärstruktur eines Peptids oder Proteins bezieht sich auf die Sequenz der Aminosäuren, welche durch Peptidbindungen verknüpft sind. Diese Sequenz bestimmt die einzigartigen Eigenschaften des gegebenen Moleküls und gibt zugleich den Bauplan für die räumliche Faltung in der Sekundär- und Tertiärstruktur.
Sekundärstruktur
Die Sekundärstruktur beschreibt lokale gefaltete Strukturen wie die α-Helix oder das β-Faltblatt, die aufgrund von Wasserstoffbrückenbindungen zwischen dem Sauerstoff der Carbonylgruppe einer Peptidbindung und dem Wasserstoff der Aminogruppe einer anderen entstehen. Diese Wasserstoffbrücken stabilisieren die gefalteten Bereiche des Proteins.
Tertiärstruktur
Die Tertiärstruktur bildet die dreidimensionale Form eines einzelnen Proteins und ergibt sich aus der Interaktion der Seitenketten der Aminosäuren. Hier spielen neben Wasserstoffbrücken auch hydrophobe Wechselwirkungen, ionische Wechselwirkungen und Disulfidbrücken eine Rolle.
Quartärstruktur
Manche Proteine bestehen aus mehreren Untereinheiten, die nicht kovalent verbunden sind. Die räumliche Anordnung dieser Untereinheiten wird als Quartärstruktur bezeichnet.
Das IMPP fragt besonders gerne nach den Details der Peptidbindung und den unterschiedlichen Strukturebenen eines Proteins, da sie für die Funktion der Proteine essenziell sind.
Struktur und Funktion
Ein gutes Beispiel für den Zusammenhang zwischen Struktur und Funktion sind die Enzyme. Zum Beispiel ist der präzise Aufbau des aktiven Zentrums, der oft aus verschiedenen, nicht benachbarten Aminosäuren stammt, entscheidend für die spezifische Funktion des Enzyms. Ohne die exakte dreidimensionale Anordnung wäre das Enzym nicht funktionsfähig.
Synthese und Analyse von Aminosäuren und Peptiden
Synthese von Aminosäuren
Bei der Synthese von Aminosäuren kommen verschiedene Methoden zum Einsatz. Die Strecker-Synthese und die Merrifield-Synthese sind zwei prominente Beispiele, die oft im Lehrstoff erwähnt werden. Die Strecker-Synthese ist eine klassische Methode zur Herstellung von Aminosäuren aus Aldehyden, während die Merrifield-Synthese vor allem in der Anwendung der Peptidchemie Bedeutung hat, da sie es ermöglicht, Peptide schrittweise aufzubauen.
Das IMPP fragt häufig nach der Strecker-Synthese, weshalb man sicherstellen sollte, die Grundlagen – Synthese aus Aldehyden mittels Cyanwasserstoff und Ammoniak – gut verstanden zu haben.
Analyse von Peptiden
Die Analyse von Peptiden kann auf verschiedene Weise erfolgen, zum Beispiel durch Titrationskurven, bei denen pKa-Werte eine Rolle spielen, oder durch Reaktion mit spezifischen Reagenzien wie Sangers Reagenz, welches spezifisch mit der freien Aminogruppe am N-Terminus eines Peptids reagiert. Die Art der Bindungen, die in Peptiden und Proteinen vorkommen – speziell die Peptidbindung und deren partieller Doppelbindungscharakter –, sind zentrale Bestandteile im Verständnis der Peptidchemie.
Beim Umgang mit Peptiden ist es wichtig zu verstehen, dass Sangers Reagenz genutzt werden kann, um die N-terminale Aminosäure zu identifizieren. Dies ist ein häufiger Prüfungspunkt.
Protektionsgruppen in der Peptidchemie
Ein weiteres prüfungsrelevantes Thema sind Protektionsgruppen, die in der Peptidsynthese eingesetzt werden, um funktionelle Gruppen vor unerwünschten Reaktionen zu schützen. Sie spielen eine Schlüsselrolle bei der Synthese von Peptiden, wie zum Beispiel Boc (tert-Butyloxycarbonyl) für die Aminogruppen und Benzylester für Carboxygruppen. Das Abspalten dieser Schutzgruppen ist ein kritischer Schritt, der genau verstanden sein muss.
Unbedingt notwendig ist das Wissen über die Verwendung und das Entfernen von Protektionsgruppen, da diese einen häufigen Bestandteil der Synthese von komplexen Peptiden darstellen.
Insgesamt sollte man beim Lernen für das Examen auf eine klare Verständnis der Eigenschaften, der Synthese und der Analytik von Aminosäuren und Peptiden fokussieren. Stelle sicher, dass du mit den basischen Konzepten vertraut bist und diese auch anwenden kannst, denn das IMPP legt großen Wert auf das praktische Verständnis dieser Materie.
Spezielle Reaktionen und chemische Eigenschaften von Aminosäuren
Aminosäuren sind die Bausteine von Proteinen und spielen eine entscheidende Rolle in fast allen biologischen Prozessen. Abseits ihrer Funktion in den Proteinen haben Aminosäuren eigenständige chemische Eigenschaften, die in spezifischen Reaktionen zum Vorschein kommen. Im Folgenden werden einige dieser speziellen Reaktionen und ihre chemischen Eigenschaften, nach denen das IMPP gerne fragt, erläutert.
Isoelektrischer Punkt (pI) und pKs-Werte
Jede Aminosäure besitzt mindestens zwei pKs-Werte, die sich auf die Amino- und Carboxylgruppen beziehen. Einige, wie Lysin mit der zusätzlichen ε-Aminogruppe, haben mehr als zwei pKs-Werte. Diese entscheidenden Größen geben an, bei welchem pH-Wert die Gruppen Protonen aufnehmen oder abgeben.
Für Aminosäuren wie Lysin ist es wichtig, die pKs-Werte und den daraus resultierenden isoelektrischen Punkt pI zu kennen. Der pI ist der pH-Wert, bei dem die Aminosäure elektrisch neutral ist und sich daher in einem Zwitterion-Zustand befindet. Dieser Wert ist wichtig für die Bestimmung der Ladung der Aminosäure in einem gegebenen pH-Bereich.
Die Reaktivität der Seitenketten
Einige Aminosäuren besitzen Seitenketten, die spezielle chemische Reaktionen eingehen können:
- Cystein kann durch Oxidation Disulfidbrücken bilden, die für die Stabilisierung von Proteinstrukturen bedeutsam sind.
- Histidin mit seinem Imidazolring kann Protonen aufnehmen und abgeben und ist deshalb oft an katalytischen Zentren von Enzymen beteiligt.
Das Verständnis der Reaktionsfähigkeit von Aminosäureseitenketten, speziell von Cystein und Histidin, ist zentral. Beide spielen eine wichtige Rolle bei Enzymreaktionen und der Ausbildung von Proteinstrukturen.
Decarboxylierung
Die Decarboxylierung ist eine Reaktion, bei der die Carboxylgruppe (-COOH) von Aminosäuren als Kohlendioxid abgespalten wird. Ein Beispiel hierfür ist die Umwandlung von Glutaminsäure in GABA (Gamma-Aminobuttersäure), einem wichtigen Neurotransmitter.
Zusammenfassung
Feedback
Melde uns Fehler und Verbesserungsvorschläge zur aktuellen Seite über dieses Formular. Vielen Dank ❤️
Footnotes
Credits Allgemeine Struktur der Aminosäuren Grafik: GYassineMrabetTalk✉ This W3C-unspecified vector image was created with Inkscape ., AminoAcidball, als gemeinfrei gekennzeichnet, Details auf Wikimedia Commons↩︎
Credits Die Peptidbindung Grafik: Renate90, Peptidbindung, CC BY-SA 3.0↩︎
Credits Proteinstrukturen Grafik: Holger87, Protein-Struktur, CC BY-SA 3.0↩︎
Credits Die Streckersynthese Grafik: GerrietB, Strecker-Synthese Übersicht V3, CC BY-SA 4.0↩︎