Ammoniak
IMPP-Score: 0.9
Ammoniak - Synthese
Die industrielle Produktion von Ammoniak ist ein faszinierendes Beispiel für die Anwendung von chemischen Prinzipien in großtechnischen Prozessen. Einer dieser Prozesse ist das Haber-Bosch-Verfahren, welches Stickstoff aus der Luft und Wasserstoff, typischerweise aus Erdgas gewonnen, unter hohem Druck und bei hohen Temperaturen in Ammoniak umwandelt. Katalysatoren auf Eisenbasis sind entscheidend, um die Reaktionsgeschwindigkeit zu erhöhen und Energieverbrauch zu minimieren. Es ist bemerkenswert, dass diese Reaktion exotherm ist, was bedeutet, dass Wärme freigesetzt wird:
\[ N_2(g) + 3H_2(g) \rightarrow 2NH_3(g) \]
Dieser Prozess ist für die Herstellung von Düngemitteln und somit für die globale Nahrungsproduktion von immensem Wert.
Es gibt auch alternative Methoden zur Ammoniaksynthese, wie beispielsweise die Reaktion von Wasser mit bestimmten Nitriden, wie Magnesiumnitrid, aber diese sind weniger verbreitet.
Ammoniak - Struktur
Ammoniak hat eine charakteristische trigonal-pyramidale Molekülgeometrie. Dieses Phänomen lässt sich durch die sp³-Hybridisierung des Stickstoffatoms und die Existenz eines nicht-bindenden Elektronenpaares erklären. Der Bindungswinkel liegt bei etwa 107° und weicht somit vom Tetraederwinkel (109.5°) ab.
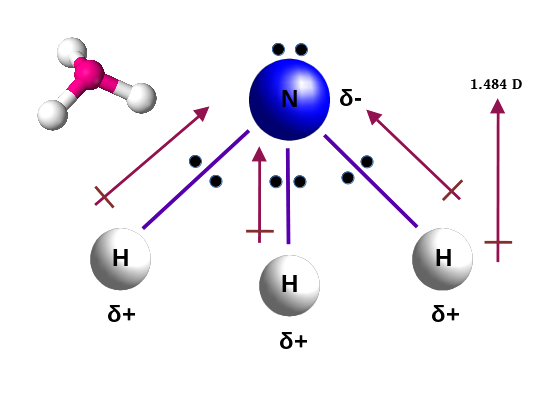
Ammoniak - Eigenschaften
Ammoniak ist ein farbloses, stechend riechendes Gas, das bei Raumtemperatur unter Normaldruck verflüssigbar ist. Die Polarisation der N-H-Bindungen tritt aufgrund der größeren Elektronegativität des Stickstoffs auf. Vergleichen wir Ammoniak mit anderen Substanzen wie Phosphin (PH₃) oder Hydroxylamin, so stellt sich heraus, dass Ammoniak eine höhere Basizität besitzt. Das impliziert eine stärkere Tendenz, Protonen aus Wasser anzuziehen und folgende Spezies zu bilden:
\[ NH_3(aq) + H_2O(l) \rightleftharpoons NH_4^+(aq) + OH^-(aq) \]
Ammoniak zeigt ebenfalls die Eigenschaft der Autoprotolyse, eine Reaktion in der zwei gleichartige Moleküle ein Proton austauschen:
\[ 2NH_3(l) \rightarrow NH_4^+(aq) + NH_2^-(aq) \]
Für das IMPP ist es besonders wichtig, die Basizität von Ammoniak im Vergleich zu anderen Molekülen zu verstehen und wie diese mit der Struktur und Elektronenanordnung des Moleküls zusammenhängt.
Ammoniak - Reaktivität
Ammoniak zeigt eine vielfältige Reaktivität. Eine bemerkenswerte Reaktion ist die Umsetzung mit Natrium, die Natriumamid (NaNH₂) und Wasserstoffgas bildet:
\[ 2NH_3(g) + 2Na(s) \rightarrow 2NaNH_2(s) + H_2(g) \]
Diese ist nützlich für die Synthese von Aminen und anderen Stickstoffverbindungen in der organischen Chemie. Die Nichtreaktivität von Ammoniak mit Grignard-Verbindungen ist ebenfalls erwähnenswert; dies liegt an den Eigenschaften des Ammoniaks als schwache Brønsted-Base, wobei es kein geeignetes Proton für die Grignard-Reaktion bietet.
Im Wasser stellt Ammoniak ein Gleichgewicht zwischen den Ammonium-Ionen und Hydroxid-Ionen her.
Bei der Reaktion mit salpetriger Säure entsteht Stickstoff:
\[ NH_3(aq) + HNO_2(aq) \rightarrow N_2(g) + 2H_2O(l) \]
Die Zersetzung von Ammoniumnitrat unter Bildung von Distickstoffmonoxid und Wasser ist ein weiteres interessantes Beispiel für die Reaktivität von Ammoniakderivaten:
\[ NH_4NO_3(s) \rightarrow N_2O(g) + 2H_2O(g) \]
In Bezug auf den pKs-Wert, das IMPP stellt häufig Fragen zur Säurestärke und dem pKs-Wert des Ammonium-Ions, welcher bei rund 9,25 liegt, was eine schwache Säure repräsentiert.
Ammoniak findet auch häufig Anwendung als Lösungsmittel in flüssiger Form und bei der Herstellung verschiedener Salze wie Ammoniumnitrat und Ammoniumnitrit, die in Düngemitteln und als Explosivstoffe verwendet werden.
Dieses Wissen ist entscheidend nicht nur für das Examen, sondern auch für das Verständnis von grundlegenden chemischen Prozessen, die globale Auswirkungen haben.
Zusammenfassung
Feedback
Melde uns Fehler und Verbesserungsvorschläge zur aktuellen Seite über dieses Formular. Vielen Dank ❤️
Footnotes
Credits Trigonal-pyramidale Molekulstruktur von Ammoniak Grafik: Arcturus10, NH3-Dipole-Moment, CC BY-SA 4.0↩︎
