Bor
IMPP-Score: 0.9
Bor und seine Verbindungen
Bor ist ein eher ungewöhnliches Element und wird als Halbmetall klassifiziert, da es sowohl Merkmale von Metallen als auch von Nichtmetallen aufweist. Im Periodensystem steht Bor an der Spitze der dritten Hauptgruppe, über Aluminium. Bor kommt in der Natur nicht elementar vor, sondern hauptsächlich in Form von Borsäure (H3BO3) und ihren Salzen, den Boraten.
Bor als Element
Das Element Bor zeigt interessante Eigenschaften und bildet eine Brücke zwischen den Metallen und Nichtmetallen. Es hat die Fähigkeit, sowohl Atombindungen als auch koordinative Bindungen einzugehen.
Bedeutung von Bor-Isotopen
Bor besitzt zwei natürliche Isotope: Bor-10 und Bor-11, wobei Bor-10 eine besondere Rolle in der Kerntechnologie und Nuklearmedizin spielt, da es einen hohen Neutroneneinfangquerschnitt besitzt. Dies wird bei Kontrollprozessen in Kernreaktoren und bei manchen Therapieverfahren in der Nuklearmedizin genutzt.
Strukturen und Reaktivitäten spezifischer Borverbindungen
Diboran (B2H6)
Eines der faszinierendsten Beispiele für Borverbindungen ist Diboran, ein Gas mit ungewöhnlichen Bindungsverhältnissen. Diboran besitzt zwei Dreizentrenbindungen, bei denen jeweils ein Elektronenpaar von drei Atomen geteilt wird. Diese Bindungen werden durch zwei Wasserstoffatome, die sogenannten Brückenwasserstoffe, etabliert. Die Reaktion von Diboran mit Wasser führt zur Bildung von Borsäure, und mit Lithiumhydrid kann Lithiumboranat hergestellt werden.
Diboran ist deshalb interessant, da es ein Beispiel für die Ausbildung von Zweielektronen-Dreizentren-Bindungen ist. In dieser speziellen Bindung sind beide Boratome mit zwei verbrückenden Wasserstoffen über zwei BHB-Dreizentrenbindungen verbunden:
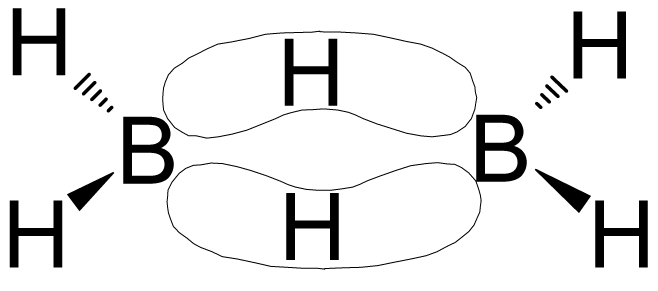
Das IMPP fragt besonders gerne nach den Bindungsverhältnissen im Diboran, also stelle sicher, dass du das Konzept der Dreizentrenbindung verstanden hast.
Tetrahydridoborat-Ionen (BH4-)
BH4- Ionen haben eine tetraedrische Struktur; jedes Bor-Atom erreicht damit seine bevorzugte Koordinationszahl von 4.
Bortrifluorid (BF3)
BF3 ist eine weitere bemerkenswerte Borverbindung. Es ist ein Molekül mit einer trigonal-planaren Struktur und sp^2-Hybridisierung des Boratoms. Diese Anordnung lässt das Boratom elektronenarm zurück, sodass es als Lewis-Säure agieren kann, d.h., es kann Elektronenpaare von anderen Molekülen akzeptieren. Bei Reaktionen mit Fluorid-Ionen werden Tetrafluoroborat-Ionen (BF4-) gebildet, die eine tetraedrische Struktur haben.
Bedenke, dass BF3 oft als Katalysator in organischen Synthesen verwendet wird, zum Beispiel in der Friedel-Crafts-Acylierung.
Weitere Borverbindungen
Borhalogenide
Bor verbindet sich mit Halogenen wie Chlor, um Borhalogenide wie BCl3 zu bilden, die wie BF3 Lewis-Säuren sind.
Borsäure
Borsäure verhält sich aufgrund der Ausbildung intermolekularer Wasserstoffbrücken stabil. Das Protolyse-Verhalten ändert sich in Gegenwart von cis-1,2-Diolen, was für analytische Zwecke genutzt wird.
Borax (Natriumtetraborat)
Borax, eine Verbindung aus Natrium, Bor, Sauerstoff und Wasser, ist bekannt für seine Verwendung als Reinigungsmittel und in glasbildenden Prozessen.
Reaktionen und Chemie von Borsäureestern
Die Reaktion von Borsäure mit cis-1,2-Diolen führt zur Bildung von Borsäureestern, was die Säurestärke von Borsäure deutlich erhöht und die Hybridisierung von sp^2 nach sp^3 ändert.
Das IMPP legt oft einen Fokus auf das reaktive Verhalten von Bor, besonders in Bezug auf die Bildung von Borsäureestern und die Veränderungen der Säurestärke sowie der Hybridisierung. Verstehe also, wie Borsäure mit Diolen reagiert.
Zusammenfassung
Feedback
Melde uns Fehler und Verbesserungsvorschläge zur aktuellen Seite über dieses Formular. Vielen Dank ❤️
Footnotes
Credits Struktur von Diboran Grafik: Steffen 962, Diborane 02, CC0 1.0↩︎
Credits Zweielektronen-Dreizentren-Bindung im Diboran-Molekül Grafik: Cvf-ps, Diboran 3ZB, als gemeinfrei gekennzeichnet, Details auf Wikimedia Commons↩︎