Löslichkeitsprodukt
IMPP-Score: 0.3
Löslichkeitsprodukt und Gleichgewichte bei schwerlöslichen Salzen
Das Löslichkeitsprodukt (\(K_L\)) stellt einen grundlegenden Begriff dar, wenn es um die Beschreibung der Löslichkeit und das Gleichgewicht schwerlöslicher Salze in wässriger Lösung geht. Es hilft zu verstehen, warum manche Salze schwer löslich sind und wie sich die Konzentrationen der Ionen in gesättigten Lösungen verhalten.
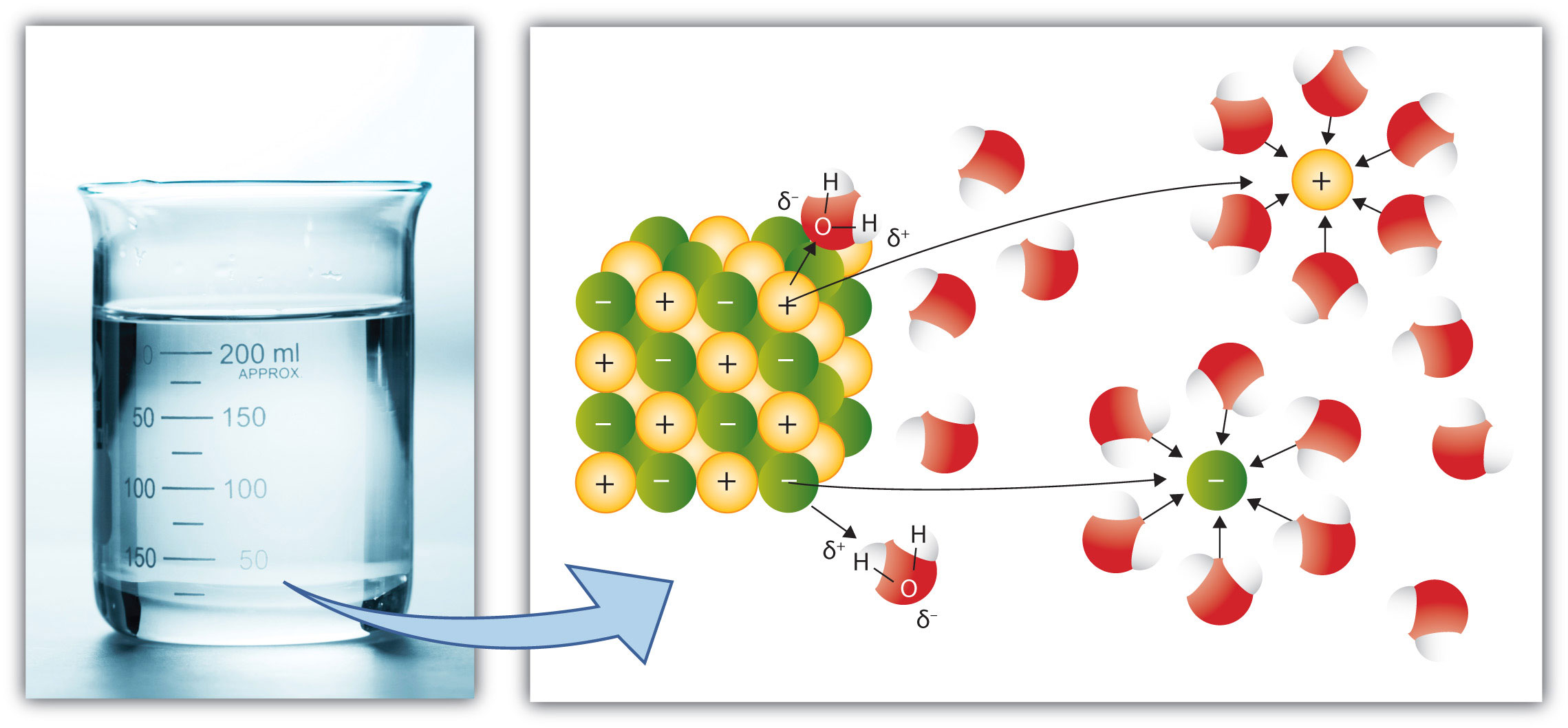
Definition des Löslichkeitsprodukts
Das Löslichkeitsprodukt beschreibt das Produkt der molaren Ionenkonzentrationen, die jeweils in ihrer stöchiometrischen Anzahl in die Gleichung eingehen. Für das Beispiel Ag\(_2\)CrO\(_4\), bei dem zwei Silberionen (Ag\(^+\)) und ein Chromat-Ion (CrO\(_4^{2-}\)) aus einem Molekül des Salzes in Lösung gehen, sieht das Löslichkeitsprodukt so aus:
\[ K_L = [Ag^+]^2 \cdot [CrO_4^{2-}] \]
Die eckigen Klammern bedeuten hier die Konzentrationen der Ionen in mol/L. Wichtig ist dabei, dass die Stöchiometrie des Salzes im Löslichkeitsprodukt berücksichtigt wird. Bei Ag\(_2\)CrO\(_4\) erscheint die Konzentration von Ag\(^+\) somit im Quadrat, da zwei Ag\(^+\)-Ionen pro CrO\(_4^{2-}\)-Ion vorhanden sind.
pK\(_L\)-Wert und seine Bedeutung
Nun ist es oft praktischer, mit dem negativen dekadischen Logarithmus des Löslichkeitsprodukts, dem pK\(_L\)-Wert, zu arbeiten. Dieser erlaubt es, mit kleineren Zahlen umzugehen und die Löslichkeit von Salzen besser zu vergleichen:
\[ pK_L = -\log(K_L) \]
Für AgCl mit einem pK\(_L\) von 10 beträgt das Löslichkeitsprodukt also 10\(^{-10}\) mol²/L². Das IMPP fragt besonders gerne nach der Berechnung dieser Werte und deren Interpretation.
Anwendung des Löslichkeitsprodukts
Das Wissen um das Löslichkeitsprodukt erlaubt es, nachzuvollziehen, wie viel von einem Salz sich maximal in einer Lösung auflösen kann, ohne dass es zu einem Niederschlag kommt. Betrachten wir die Ionenkonzentrationen von AgCl:
\[ K_L = [Ag^+] \cdot [Cl^-] \]
Kennt man die Konzentration der Chlorid-Ionen, kann man die maximal mögliche Silberionen-Konzentration berechnen. Überschreitet diese den durch das Löslichkeitsprodukt gegebenen Wert, beginnt AgCl als Niederschlag auszufallen.
Das Löslichkeitsprodukt ist eine stoffspezifische Konstante und hängt von den Ionenaktivitäten im Lösungsmittel im Sättigungszustand ab – nicht von der Anzahl der gelösten Partikel.
Löslichkeitsprodukt am Beispiel von Ag2CrO4
Nehmen wir das Beispiel des Silberchromats (Ag2CrO4), das in Wasser gelöst wird. Sobald das Löslichkeitsprodukt, ein spezielles Gleichgewicht, das für schwerlösliche Salze definiert ist, überschritten wird, beginnt das Salz auszufallen. Die Gleichgewichtsreaktion für die Auflösung von Ag2CrO4 in Wasser lautet:
\[ Ag_2CrO_4 (s) ⇌ 2 Ag^+ (aq) + CrO_4^{2-} (aq) \]
Das Löslichkeitsprodukt (L) für diese Reaktion ist definiert als:
\[ L = [Ag^+]^2 \cdot [CrO_4^{2-}] \]
wobei die eckigen Klammern die Konzentrationen der Ionen in der Lösung anzeigen. Für eine gesättigte Lösung von Ag2CrO4 können diese Konzentrationen mithilfe des Löslichkeitsproduktes berechnet werden.
Das Löslichkeitsprodukt ist entscheidend, um zu verstehen, wie viel von einem schwerlöslichen Salz in Lösung gehen kann und ab wann die Ausfällung beginnt.
Konzentrationsberechnungen mit dem Löslichkeitsprodukt
Betrachten wir die Berechnung der Ionenkonzentrationen für Ag\(_2\)CrO\(_4\) und wie man diese über das Löslichkeitsprodukt finden kann. Wenn Ag\(^+\) mit einem Faktor \(x\) in Lösung geht, geht CrO\(_4^{2-}\) mit dem Faktor \(0,5x\) in Lösung, da die stöchiometrische Verhältnis 2:1 beträgt. Um die Konzentration der Ionen zu finden, setzt man diese Verhältnisse in die Gleichung für \(K_L\) ein und löst dann nach \(x\) auf.
Bedeutung des Löslichkeitsprodukts für schwerlösliche Substanzen
Schwerlösliche Substanzen wie Arsen(III)sulfid sind interessant, da sie ausfallen können, ohne die Konzentration der Sulfid-Ionen signifikant zu beeinflussen. Dies zeigt, dass das Löslichkeitsprodukt eine wichtige Rolle spielt, wenn es um das Verhalten von Ionen in gesättigten Lösungen und um die Bildung von Niederschlägen geht.
Realitätsnahe Beispiele und Prüfungsrelevanz
In Prüfungen könnten Fragen gestellt werden, wie: “Welche Maximal-Konzentration von \(Ag^+\) liegt vor, bevor \(AgCl\) ausfällt, wenn die \(Cl^-\)-Konzentration bekannt ist?” Hier ist es besonders wichtig, dass ihr stets das stöchiometrische Verhältnis der Ionen in euren Löslichkeitsprodukt-Gleichungen korrekt einhaltet.
Dies sind die grundlegenden Konzepte rund um das Löslichkeitsprodukt und die Gleichgewichte bei schwerlöslichen Salzen, die ihr für euer Examen verstehen und anwenden solltet.
Zusammenfassung
Feedback
Melde uns Fehler und Verbesserungsvorschläge zur aktuellen Seite über dieses Formular. Vielen Dank ❤️
Footnotes
Credits Lösungsvorgang Grafik: Andy Schmitz, Sodium chloride dissolution, CC BY 3.0↩︎
