Hydride
IMPP-Score: 1
Einführung in die Hydridverbindungen
Hydridverbindungen sind chemische Verbindungen, die aus Wasserstoff und einem weiteren Element bestehen. In diesen Verbindungen nimmt Wasserstoff meist die Oxidationsstufe -1 an und wird daher als Hydridion \(H^-\) bezeichnet. Dieses Ion ist eine sehr starke Base und zugleich eine extrem schwache Säure, was bedeutet, dass es in der Lage ist, ein Elektron zu spenden, aber kaum in der Lage ist, ein Proton (\(H^+\)) abzugeben.
In Hydridverbindungen wie Natriumhydrid (NaH) besitzt Wasserstoff die Oxidationsstufe -1.
Elektronegativität und Hydridionenbildung
Die Bildung von Hydridionen ist stark abhängig von der Elektronegativität der beteiligten Elemente. Wasserstoff bildet mit weniger elektronegativen Elementen, typischerweise Metallen wie Natrium, ein Hydridion. Dagegen bildet er mit elektronegativeren Elementen, wie Kohlenstoff oder Stickstoff, keine Hydridionen. In Verbindung mit metallischen Elementen, die eine niedrigere Elektronegativität haben als der Wert von Wasserstoff (etwa 2.20), entstehen durch Elektronenübergang salzartige bzw. ionische Strukturen.
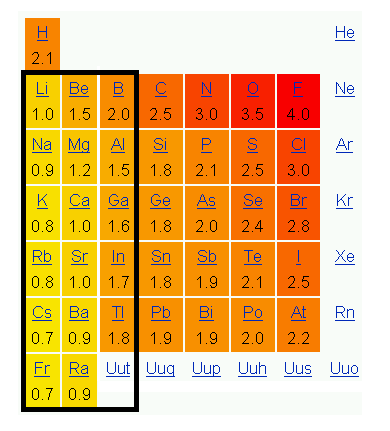
In den ersten 3 Hauptgruppen ist die Elektronegativität der Elemente konstant geringer als die von Wasserstoff. Fast alle Fragen waren mit dieser Daumenregel bereits beantwortbar. Bei allen anderen Elementen ist es nicht mehr so leicht merkbar, lediglich Silicium (und alle Elemente darunter) sollte man sich als weiteres Beispiel für einen elektropositiveren Partner merken.
Arten von Hydridverbindungen
Der strukturelle Aufbau und die Reaktivität von Hydriden variieren je nach Art der Bindungen und der Bindungspartner. Wir unterscheiden im Wesentlichen vier Typen von Hydriden:
- Metallhydride: Verbindungen von Wasserstoff mit Metallen, wie Natriumhydrid (NaH).
- Salzartige Hydride: Ebenfalls Metallverbindungen, aber eher ionischer Natur mit starker Elektronegativitätsdifferenz, wie bei LiH.
- Kovalente Hydride: Verbindungen, in denen Wasserstoff mit Nichtmetallen kovalente Bindungen eingeht, zum Beispiel Monosilan (SiH4).
- Komplexe Hydride: Spezielle Verbindungen mit mehreren Metall- und Wasserstoffatomen, wie Lithiumaluminiumhydrid (LiAlH4).
Beachte die Strukturvielfalt: Metallhydride (NaH), salzartige Hydride (LiH), kovalente Hydride (SiH4) und komplexe Hydride (LiAlH4).
Struktur von Hydriden
Hydridverbindungen wie Natriumhydrid zeigen eine ionische Kristallstruktur, bei der Natriumkationen (\(Na^+\)) und Hydridanionen (\(H^-\)) abwechselnd angeordnet sind. Die Bindung zwischen Na und H ist überwiegend ionisch aufgrund deutlicher Elektronegativitätsunterschiede.
Komplexe Hydride wie Lithiumaluminiumhydrid weisen hingegen eine Polymerstruktur auf. Durch die Anwesenheit mehrerer Wasserstoffatome und die Eigenschaft von Aluminium, mit mehreren Hydrogenatomen zu binden, entsteht eine Struktur mit Wasserstoffbrückenbindungen und Elektronenmangelbindungen.
Reaktivität von Hydridverbindungen
Die Reaktion mit Wasser ist ein charakteristisches Merkmal vieler Hydride. So reagiert NaH unter Freisetzung von Wasserstoffgas, einer Reaktion, die dei Bedeutung von Hydriden als starke Reduktionsmittel in der organischen Chemie unterstreicht.
Das IMPP fragt besonders gerne nach der Reaktion von Metallhydriden wie NaH mit Wasser – dabei wird H2 freigesetzt.
Praktische Anwendungen
Hydride wie NaH werden in der organischen Synthese genutzt, um beispielsweise H2 zu produzieren oder um andere Reduktionen durchzuführen.
Thermische Stabilität und Autoprotolyse
Die thermische Stabilität von Hydriden variiert. So zeigt sich, dass mit steigender Ordnungszahl des zentralen Elements die Stabilität innerhalb einer Hauptgruppe zu- oder abnehmen kann. Manche Hydride neigen zur Autoprotolyse, was bedeutet, dass sie als Säure und Base fungieren können, indem sie sich selbst protonieren und deprotonieren.
In Prüfungsfragen sind oft Eigenschaften wie die thermische Stabilität von Hydriden verschiedener Hauptgruppen relevant.
Oxidationsstufen und Polarität der Bindungen
In Hydridverbindungen kann Wasserstoff im Kontext der angesprochenen Oxidationsstufe -1 auch verschiedenartig polarisiert sein – entweder als partiell negativ in salzartigen Hydriden oder als partiell positiv in kovalenten Hydriden, wo er als Oxidationsmittel fungiert.
Fazit
An dieser Stelle solltest du nun den Überblick über die Vielfalt und die Eigenschaften von Hydridverbindungen haben, ihre Bindungsarten verstehen und die Reaktivität sowie Anwendungen im Hinterkopf behalten. Das IMPP legt Wert darauf, dass du die unterschiedlichen Hydridtypen und deren charakteristische Eigenschaften kennst und auf ihre Stabilität und Reaktivität eingehen kannst.
Zusammenfassung
Feedback
Melde uns Fehler und Verbesserungsvorschläge zur aktuellen Seite über dieses Formular. Vielen Dank ❤️
Footnotes
Credits Elektronegativität bei Hydriden Grafik: Joanjoc at Catalan Wikipedia, Taula periòdica electronegativitat, bearbeitet von MK, CC0 1.0↩︎
