Stereoselektive Synthese
IMPP-Score: 0.9
Stereoselektive Synthese
Die stereoselektive Synthese ist ein grundlegendes Prinzip in der organischen Chemie, das darauf abzielt, gezielt ein bestimmtes Stereisomer als Hauptprodukt aus einer chemischen Reaktion zu gewinnen. Der Schlüssel liegt in der bewussten Steuerung der räumlichen Anordnung der Atome während der Synthese. Lasst uns tiefer in einige spezielle Reaktionsmechanismen eintauchen, die das IMPP gerne abfragt.
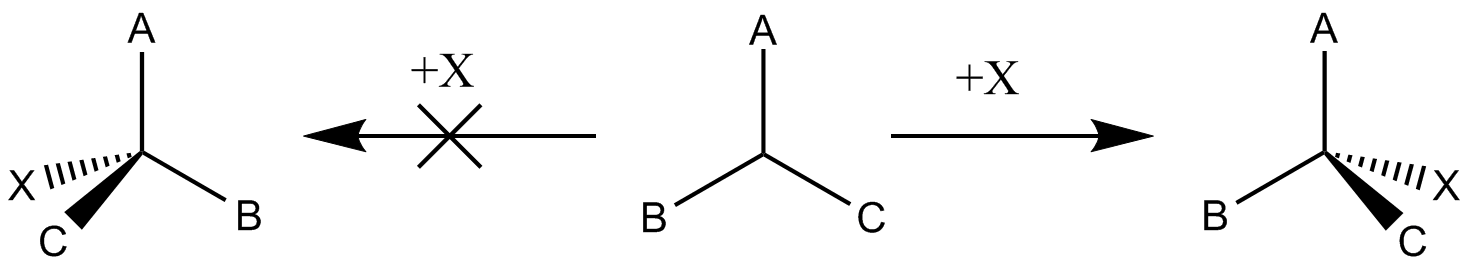
SN1-Reaktionen und Stereoselektivität
Bei einer SN1-Reaktion bildet sich zunächst ein positiv geladenes Carbenium-Ion, welches von der sterisch weniger gehinderten Seite her angegriffen wird. Dies erklärt, warum häufig ein überwiegendes trans-Produkt gebildet wird.
Bei einer SN1-Reaktion entsteht ein Carbenium-Ion, das von Nukleophilen angegriffen werden kann. Hier ist die Möglichkeit der Racemisierung gegeben, da der Angriff auf das Carbenium-Ion aus verschiedenen räumlichen Richtungen erfolgen kann.
SN2-Reaktionen und der Einfluss auf die Stereochemie
Wichtig sind auch euer Wissen um SN2-Reaktionen und ihr Verständnis für die damit verbundene Inversion der Konfiguration am Reaktionszentrum. Im Gegensatz zu SN1-Reaktionen entsteht hier kein Racemat.
E2-Reaktionen und Stereoselektivität
Im Fall von E2-Reaktionen geschieht die Eliminierung von Atomen oder Gruppen aus dem Substrat oftmals in einer Weise, dass bevorzugt ein bestimmtes Stereoisomer - typischerweise in trans-Konfiguration - entsteht. Das beruht auf einem konzertierten Mechanismus, der für seine Stereoselektivität bekannt ist.
Stereoselektive Addition an Alkene
Die Reaktion von Alkenen mit Elektrophilen, wie z.B. die elektrophile Addition von Brom an (E)-But-2-en, führt zur Bildung eines Bromonium-Ions. Das führt dazu, dass die nachfolgende Addition eines Nukleophils über die Rückseite des Bromonium-Ions erfolgen muss. Dies resultiert in einer anti-Addition, die zwei neue Chiralitätszentren in unterschiedlicher räumlicher Anordnung hervorbringt.
Chemoselektivität und Reagenzien
Die Stereoselektivität ist eng verknüpft mit der Chemoselektivität - dem Konzept, dass bestimmte funktionelle Gruppen bevorzugt reagieren. Natriumborhydrid (NaBH4) ist ein gängiges Reduktionsmittel, das selektiv Aldehyde und Ketone reduziert, während es Ester in der Regel unverändert lässt.
NaBH4 ist ein chemoselektives Reduktionsmittel, das insbesondere in der Reduktion von Aldehyden und Ketonen wichtig ist. Kenntnisse über solche Reagenzien helfen euch dabei, die gewünschten Stereoisomere effizient herzustellen.
Umgang mit Racematen und Trennung von Stereoisomeren
Ihr solltet wissen, dass die Spaltung von Racematen oft durch Reaktion mit einem enantiomerenreinen Reagenz zu diastereomeren Salzen führt. Diastereomere haben im Vergleich zu Enantiomeren unterschiedliche physikalische Eigenschaften, welche ihre Trennung erleichtern.
Im Kontext des IMPP ist die Trennung von Stereoisomeren eine Standardfrage, ebenso wie die Umstände, unter denen Racemisierung auftreten kann - etwa während der Behandlung chiraler Verbindungen mit Basen oder Säuren.
Aspekte der Enantiomerenüberschuss-Bestimmung
Der Enantiomerenüberschuss (e.e.) ist ein relevantes Maß für die Effizienz enantioselektiver Reaktionen. Ein tieferes Verständnis des Enantiomerenüberschusses ermöglicht die Auswertung und Quantifizierung der optischen Reinheit von chiralen Produkten.
Radikalische Additionen und ihre Stereoselektivität
Bei radikalischen Additionen, wie sie durch Dibenzoylperoxid ausgelöst werden, entstehen im Allgemeinen Gemische verschiedener Konfigurationsisomere, weil die Radikale schnell mit unterschiedlichen räumlichen Orientierungen weiterreagieren.
Zusammenfassung
Feedback
Melde uns Fehler und Verbesserungsvorschläge zur aktuellen Seite über dieses Formular. Vielen Dank ❤️
Footnotes
Credits Stereoselektive Synthese Grafik: Takuro Kato, Stereoselektive Synthesis, als gemeinfrei gekennzeichnet, Details auf Wikimedia Commons↩︎
