Nitro- und Nitrosoverbindungen
IMPP-Score: 1.2
Nitro- und Nitrosoverbindungen: Definitionen und Klassifizierung
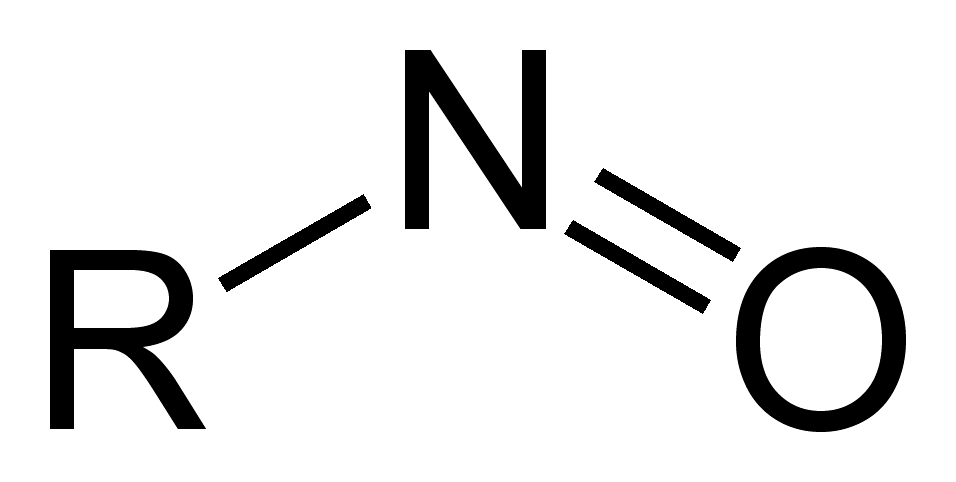
Nitro- und Nitrosoverbindungen sind wichtige Substanzklassen in der organischen Chemie, die durch das Vorhandensein spezifischer Nitrogenoxid-Gruppen gekennzeichnet sind. Nitroverbindungen besitzen eine -NO2-Gruppe, während Nitrosoverbindungen eine -N=O-Funktionalität aufweisen. Eine besondere Gruppe bilden die Nitrosamine, in denen die Gruppe -N(NO)R2 enthalten ist, wobei R Alkyl- oder Arylgruppen darstellen.
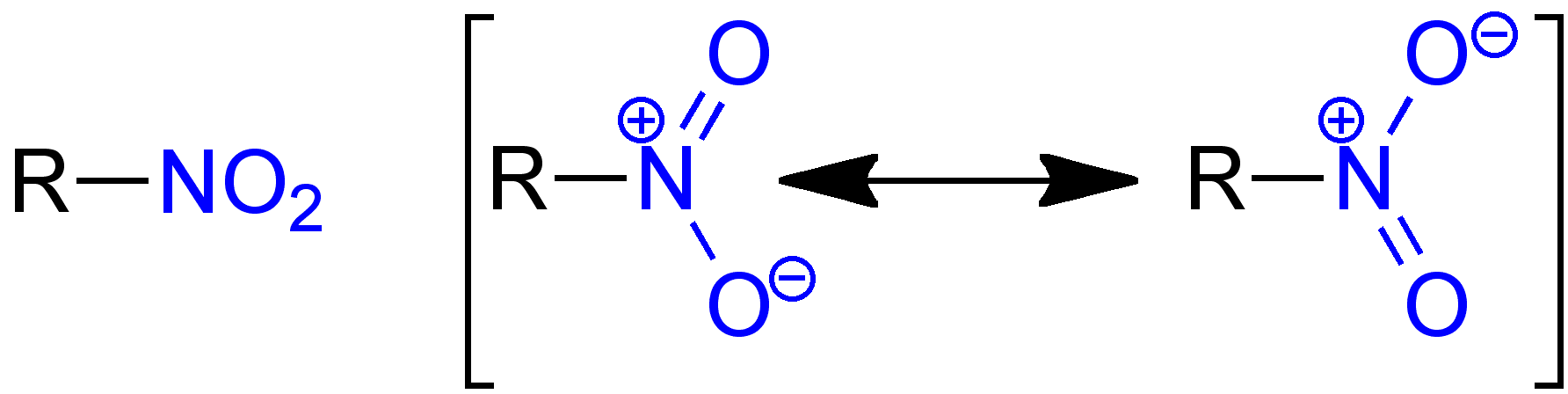
Die Anwesenheit der -NO2- bzw. -N=O-Funktionen ist das Schlüsselmerkmal für die Identifikation von Nitro- und Nitrosoverbindungen.
Herstellung
Nitroverbindungen
Nitroverbindungen, besonders Nitroaromaten, werden üblicherweise durch Nitrierungsreaktionen dargestellt. Bei diesem Prozess wird eine -NO2-Gruppe an einem Aromaten durch die Reaktion mit Nitriersäure, einer Mischung aus konzentrierter Salpetersäure und Schwefelsäure, eingeführt.
Nitrosoverbindungen und Nitrosamine
Nitrosoverbindungen entstehen oft durch die Oxidation von primären Aminen oder durch direkte Nitrosierung sekundärer Amine. Nitrosierende Agentien sind dabei häufig in situ erzeugte Nitrosyl-Ionen (NO+).
Eigenschaften
Elektronenziehende Wirkung
Die Nitrogruppe ist stark elektronenziehend und beeinflusst daher die Eigenschaften benachbarter funktioneller Gruppen. Im Falle von Nitrophenolen führt das zu einer erhöhten Acidität im Vergleich zu Phenol. Der pKs-Wert von 2-Nitrophenol ist niedriger als der von 3-Nitrophenol, da im ortho-substituierten Derivat die deprotonierte Form besser stabilisiert wird.
CH-Acidität
Nitroverbindungen wie Nitromethan zeigen eine signifikante CH-Acidität, wobei die Nitrogruppe zur Stabilisierung des resultierenden Anions beiträgt.
Reaktionen: Reduktion zu Aminen
Reduktionsmittel können Nitroverbindungen in Amine umwandeln, ein Schritt, der oft in der Synthese von Pharmaka und Farbstoffen genutzt wird. Hierfür kommen verschiedene Methoden zum Einsatz:
- Hydrierung mit Wasserstoff und einem Katalysator, z.B. Palladium-Kohle.
- Metallisches Eisen in Salzsäure.
- Lithiumaluminiumhydrid (LAH), das besonders bei der Reduktion aliphatischer Nitroverbindungen verwendet wird.
Die Produkte solcher Reduktionen sind primäre, sekundäre oder tertiäre Amine, abhängig von der Ausgangsverbindung.
Das IMPP fragt besonders gerne nach den Reduktionsmethoden von Nitroverbindungen und deren Produkten.
Besondere Aspekte
Tautomerie von Nitrosoverbindungen
Nitrosoverbindungen können tautomer sein und je nach pH-Wert oder Lösungsmittel die Nitrosonium- oder Oximform annehmen.
Nitrosamine
Nitrosamine bilden sich durch Reaktion sekundärer Amine mit Nitrosierungsreagenzien. Sie sind in der öffentlichen Wahrnehmung, da viele von ihnen als krebserregend klassifiziert sind.
Anwendung
Am Beispiel von Nitroverbindungen: Während 4-Nitrotoluen aufgrund der meta-dirigierenden Wirkung der Nitrogruppe elektrophile aromatische Substitutionen vorwiegend in den Positionen 3 und 5 eingeht, kann es durch Reduktion in das entsprechende Toluidin-Derivat überführt werden, das dann für weitere chemische Synthesen eingesetzt werden kann.
Wichtigkeit der Nitrogruppe unter hohen Temperaturen
Es ist wichtig zu wissen, dass Nitrogruppen enthaltende Verbindungen bei hohen Temperaturen zerfallen können, was zur Freisetzung von Stickstoffgas und zur Bildung anderer Produkte führt. Diese Kenntnis ist besonders bei der Brandanalytik und in der Sicherheitschemie von Bedeutung.
Das Erkennen und Analysieren der Produkte von Nitrogruppen enthaltenden Verbindungen unter hohen Temperaturen ist ein gefragtes Wissensgebiet.
Diese Inhalte bieten euch eine solide Grundlage, um Nitro- und Nitrosoverbindungen in ihrer Komplexität zu verstehen und auf Fragen bezüglich ihrer Herstellung, Eigenschaften und Reaktionen im Examen gut vorbereitet zu sein.
Zusammenfassung
Feedback
Melde uns Fehler und Verbesserungsvorschläge zur aktuellen Seite über dieses Formular. Vielen Dank ❤️
Footnotes
Credits Die Nitrogruppe Grafik: Jü, Nitro Group Structural Formulae V.3, als gemeinfrei gekennzeichnet, Details auf Wikimedia Commons↩︎
Credits Die Nitrosogruppe Grafik: , Nitroso-compound-2D, als gemeinfrei gekennzeichnet, Details auf Wikimedia Commons↩︎
