Verbindungen mit mehreren Chiralitätszentren
IMPP-Score: 1.8
Einführung in die Stereochemie mit mehreren Chiralitätszentren
In der Stereochemie beschäftigst du dich mit der räumlichen Anordnung von Atomen in Molekülen. Besonders spannend wird es, wenn Verbindungen mehrere Chiralitätszentren besitzen. Ein Chiralitätszentrum ist ein Kohlenstoffatom, das vier verschiedene Substituenten trägt, wodurch zwei spiegelbildliche, aber nicht deckungsgleiche Strukturen entstehen: die Enantiomere.
Bei Verbindungen mit mehreren Chiralitätszentren addiert sich die Komplexität, da jedes Zentrum entweder die R- oder S-Konfiguration aufweisen kann. Die Bestimmung der absoluten Konfigurationen, d.h. R oder S, erfolgt anhand definierter Prioritätsregeln und ist essenziell für das tiefergehende Verständnis der Stereochemie.
Das Konzept der Meso-Verbindungen
Ein zentraler Aspekt beim Verständnis von Verbindungen mit mehreren Chiralitätszentren ist das Konzept der meso-Verbindungen. Diese entstehen, wenn sich in einem Molekül Chiralitätszentren befinden, die durch Symmetrieelemente wie eine Spiegelebene intern kompensiert werden.
meso-Verbindungen enthalten zwar chirale Zentren, sind aber insgesamt achiral und optisch inaktiv, da die durch Symmetrie bedingte Spiegelbildlichkeit innerhalb der Molekülstruktur die Chiralität aufhebt.
Ein klassisches Beispiel für eine meso-Verbindung ist die meso-Weinsäure, die trotz zweier Chiralitätszentren achiral bleibt, weil eine Spiegelebene durch beide Zentren verläuft.
Pseudochiralitätszentren und ihre Bedeutung
Es gibt Situationen, in denen potenzielle Chiralitätszentren achiral wirken, weil sie Teile einer symmetrischen Struktur sind. Diese Zentren nennt man Pseudochiralitätszentren.
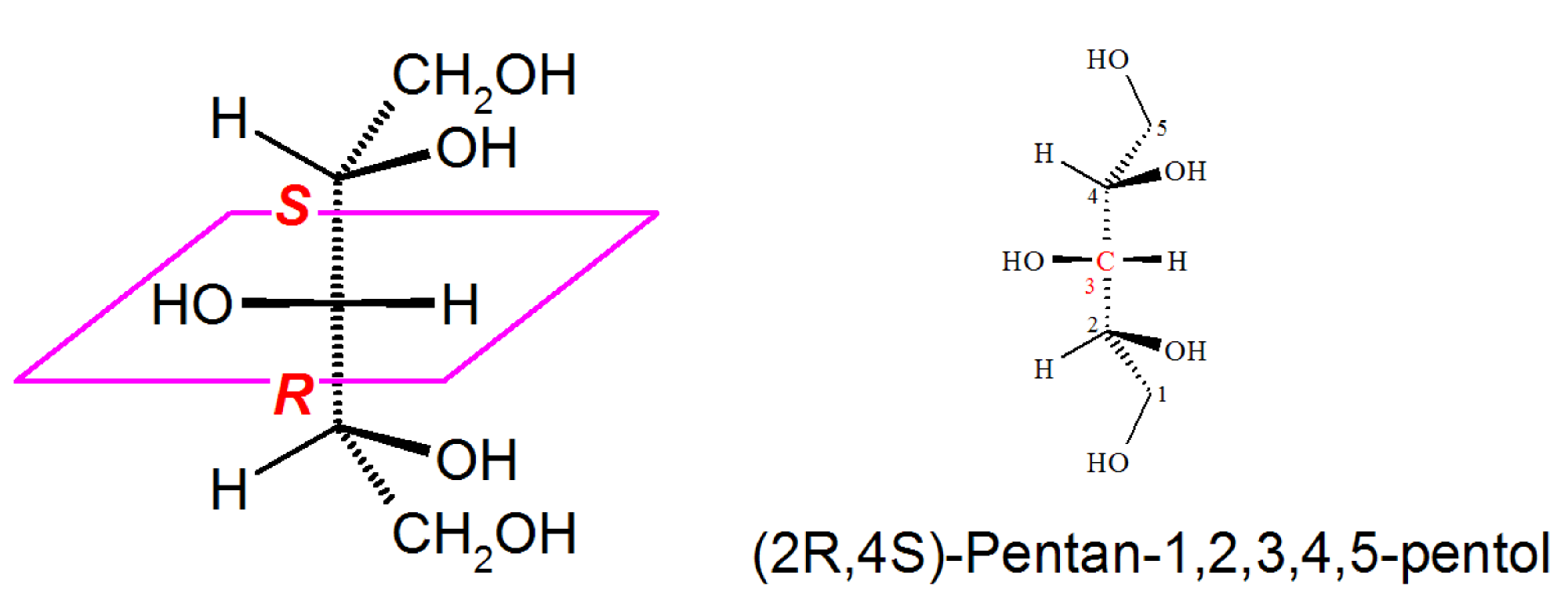
Ein Pseudochiralitätszentrum tritt in einer Molekülstruktur auf, wenn ein Kohlenstoffatom vier unterschiedliche Substituenten trägt, die durch die Molekülsymmetrie als paarweise identisch betrachtet werden.
Stereoisomere und die 2^n-Regel
Für gewöhnlich gilt die Regel, dass eine Verbindung mit n Chiralitätszentren bis zu \(2^n\) Stereoisomere aufweisen kann. Diese Stereoisomere können Enantiomere oder Diastereomere sein. Diastereomere sind Isomere, die sich in der Konfiguration mindestens eines Chiralitätszentrums unterscheiden.
Das IMPP fragt besonders gerne nach der 2^n-Regel und wie meso-Formen diese Regel beeinflussen. Es ist wichtig zu verstehen: meso-Formen reduzieren die theoretisch mögliche Anzahl von Stereoisomeren.
Die Anzahl der Stereoisomere im Licht von Meso-Formen
Die Kombination aus R- und S-Konfigurationen kann durch das Vorhandensein meso-Formen kompliziert werden. Diese Formen lassen sich nicht als Enantiomere trennen, was eine praktische Bedeutung in der Synthese optisch aktiver Substanzen hat.
Diastereomerenbeziehungen
Diastereomere können sich in vielen Eigenschaften unterscheiden, wie z.B. Schmelzpunkt und Löslichkeit. Diese Unterschiede machen Diastereomere trennbar, was bei Enantiomeren nicht der Fall ist.
Diastereomere Differenzieren sich energetisch und durch physikalische Eigenschaften, die wichtig für praktische Anwendungen, wie z.B. die Trennung diastereomerer Mischungen sind.
Generell ist die Beachtung von Symmetrien und Stereoisomeren ein Schlüsselkonzept für Verbindungen mit mehreren Chiralitätszentren, da diese Erkenntnisse für die Vorhersage von Reaktivität und Produktverhältnissen in Synthesen von entscheidender Bedeutung sind.
Epimere
Epimere sind spezielle Typen von Diastereomeren, die sich ausschließlich an einem einzigen Chiralitätszentrum unterscheiden. Betrachtet man also eine Verbindung mit mehreren stereogenen Zentren, so wäre jedes Isomer, das sich nur an einem dieser Zentren unterscheidet, ein Epimer bezüglich dieses Zentrums.
Besonders bei Zuckern spielt die Epimerisierung eine zentrale Rolle. Nehmen wir das Beispiel der D-Glucose und D-Mannose: Diese beiden Aldohexosen unterscheiden sich nur in der Konfiguration am zweiten Kohlenstoff (C2). Trotzdem hat dieser Unterschied weitreichende Auswirkungen auf die physikalischen und biologischen Eigenschaften.
Das IMPP fragt besonders gerne nach dieser subtilen, aber signifikanten Veränderung. Bei der Epimerisierung ändert sich die Konfiguration genau an einem Stereozentrum, was zu verschiedenen biologischen Eigenschaften führen kann.
Zusammenfassung
Feedback
Melde uns Fehler und Verbesserungsvorschläge zur aktuellen Seite über dieses Formular. Vielen Dank ❤️
Footnotes
Credits Konzept der Pseudochiralität durch Symmetrieelemente Grafik: muellerb, Xylit, als gemeinfrei gekennzeichnet, Details auf Wikimedia Commons↩︎
Credits Epimere Grafik: Fvasconcellos 21:12, 15 October 2007 (UTC), Doxorubicin–epirubicin comparison, als gemeinfrei gekennzeichnet, Details auf Wikimedia Commons↩︎
