Halogensauerstoffsäuren
IMPP-Score: 0.9
Allgemeines
Halogensauerstoffsäuren sind eine interessante Gruppe von anorganischen Säuren, die dich sicherlich im Examen beschäftigen werden. Sie zeichnen sich durch die Kombination von Halogenatomen mit Sauerstoff und Wasserstoff aus und folgen der allgemeinen Formel \(HXO_n\), wobei \(X\) für das Halogen (Fluor, Chlor, Brom, Iod) steht und \(n\) die Anzahl der Sauerstoffatome angibt.
| Oxidationsstufe des Halogens | Säuren Name | Säuren Summenformel | Salze Name | Salze Summenformel |
|---|---|---|---|---|
| +1 | Hypohalogenige Säuren | \(HXO\) | Hypohalogenite | \(MXO\) |
| +3 | Halogenige Säuren | \(HXO_2\) | Halogenite | \(MXO_2\) |
| +5 | Halogensäuren | \(HXO_3\) | Halogenate | \(MXO_3\) |
| +7 | Perhalogensäuren | \(HXO_4\) | Perhalogenate | \(MXO_4\) |
Diese Säuren und ihre Salze sind für die Chemie enorm wichtig, da sie in unterschiedlichsten Bereichen wie der Desinfektion, der Chemieanalytik und der Industrie genutzt werden. Insbesondere wegen ihrer Fähigkeit, als starke Oxidationsmittel zu fungieren, sind Halogensauerstoffsäuren unverzichtbar. Aber auch ihre Salze, wie Natriumhypochlorit, Kaliumbromat und Natriummetaperiodat, haben enorme praktische Bedeutung.
Ein anschauliches Beispiel, das du sicher kennst, ist die Verwendung von Natriumhypochlorit als Bleich- und Desinfektionsmittel. Diese Verbindungen spielen aber auch eine wichtige Rolle in analytischen Verfahren wie der Bromatometrie oder Iodatometrie.
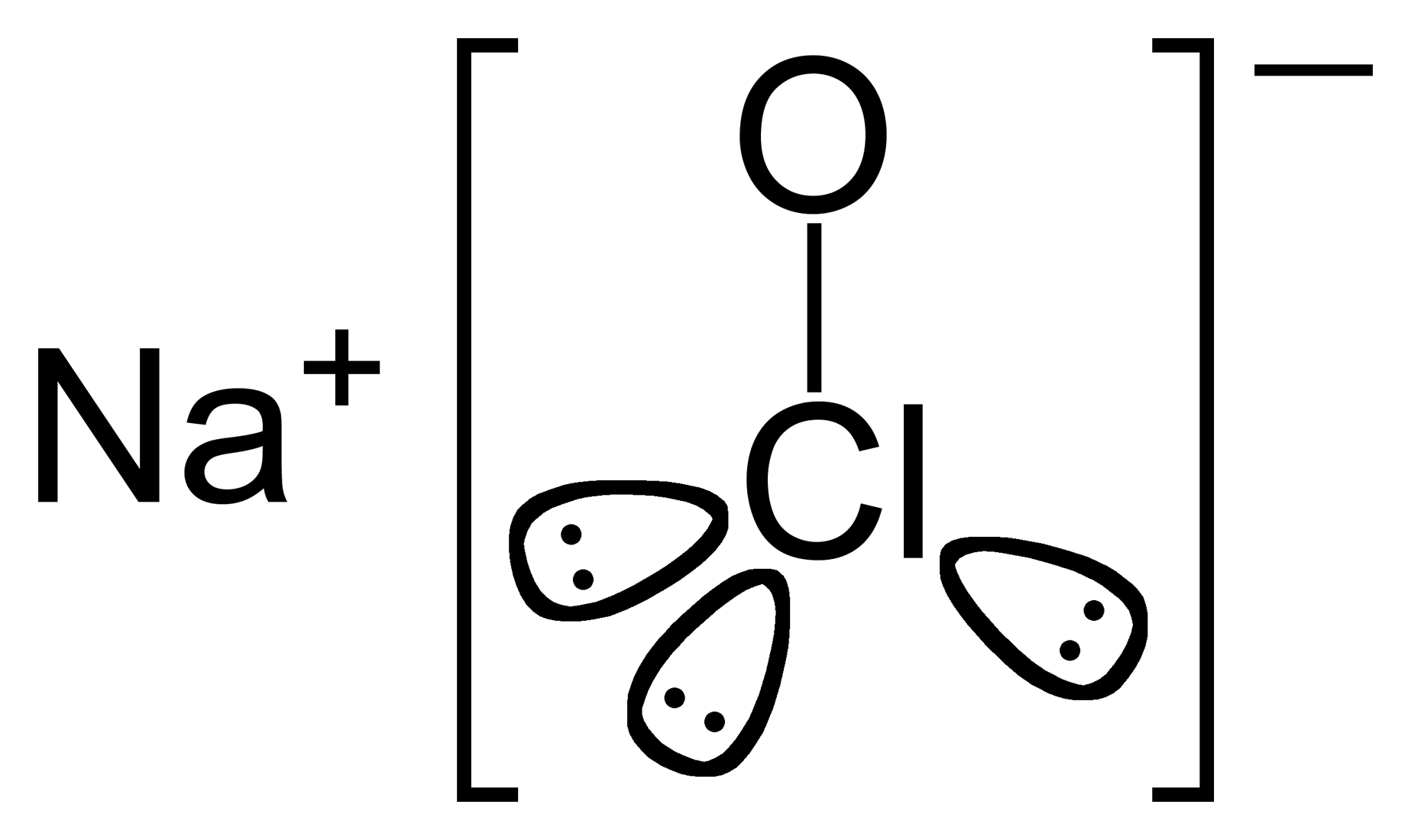
Du wirst sehen, dass es zwischen den realen Halogensauerstoffsäuren und den sogenannten Pseudohalogenen wie Cyanid (CN-) Ähnlichkeiten in Reaktivität und Eigenschaften gibt, die ihr euch genauer ansehen solltet.
Strukturen
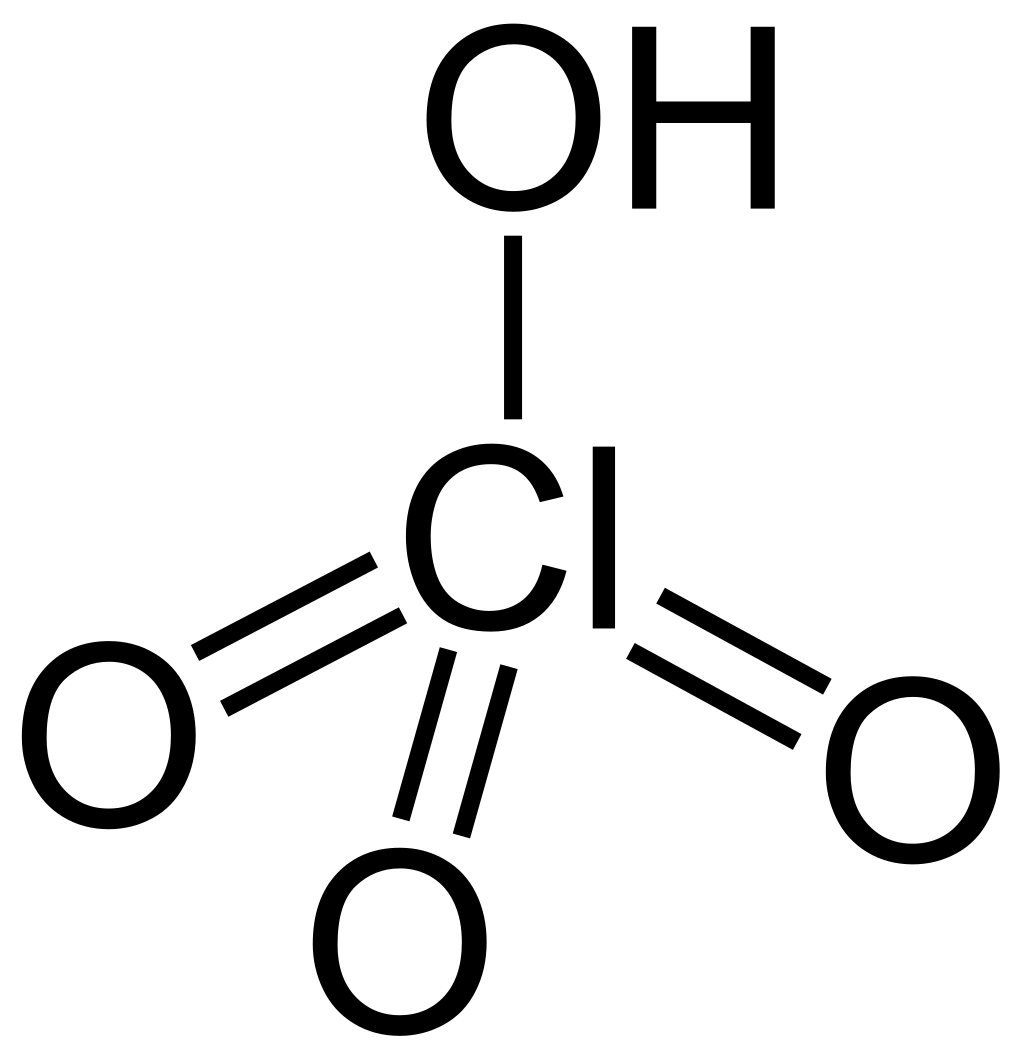
Ein tiefes Verständnis der Strukturen ist essentiell, wenn du die Eigenschaften und Reaktivitäten von Halogensauerstoffsäuren und deren Salzen verstehen willst. Nehmen wir zum Beispiel Perchlorsäure (\(HClO_4\)), eine Säure mit einem Chloratom, umgeben von vier Sauerstoffatomen in einer tetraedrischen Anordnung. Dies resultiert aus der VSEPR-Theorie, welche die Repulsion freier Elektronenpaare und Bindungselektronenpaare berücksichtigt.
Oder schauen wir uns die Orthoperiodsäure (\(H_5IO_6\)) an: Sie hat ein zentrales Iodatom, welches von sechs Sauerstoffatomen umgeben ist, mit zwei der Sauerstoffe als Hydroxylgruppen gebunden. Die Struktur wird auch von der Anzahl und Anordnung der Sauerstoffatome diktiert und führt zur höchsten Oxidationsstufe des Iods, +VII.
Hypochlorige Säure (\(HClO\)), ein weiteres Beispiel, hat eine gebogene Molekülstruktur aufgrund des Einflusses der freien Elektronenpaare auf dem Sauerstoffatom.
Eigenschaften und Reaktivität
Die Oxidationsstufen der Halogene in diesen Verbindungen sind kritisch für ihre Eigenschaften und Reaktivität. Perchlorsäure zum Beispiel ist eine extrem starke Säure, gerade weil Chlor in der Oxidationsstufe +VII auftritt. Andererseits sind Salze wie Kaliumperchlorat (\(KClO_4\)) bekannt für ihre Beständigkeit und geringe Löslichkeit in kaltem Wasser.
Merke dir, dass höhere Oxidationsstufen des zentralen Halogens einer höheren Säurestärke und Oxidationskraft entsprechen.
Kaliumchlorat (\(KClO_3\)), ein Salz der Chlorsäure (\(HClO_3\)), zersetzt sich beim Erhitzen unter Abgabe von Sauerstoff, was in der Chemie und Pyrotechnik ausgenutzt wird.
Das IMPP fragt besonders gerne nach der Rolle von Halogensauerstoffsäuren und ihren Salzen als Oxidationsmittel in der analytischen Chemie und Industrie.
Herstellung und synthetische Methoden
Die Synthese von Halogensauerstoffsäuren und deren Salzen kann variieren. Zum Beispiel entstehen Perchlorate durch anodische Oxidation von Chloraten. Dichlorheptaoxid (\(Cl_2O_7\)), das Anhydrid der Perchlorsäure (\(HClO_4\)), zeigt eindrücklich den Zusammenhang zwischen Säuren und ihren Anhydriden.
Sicherheitsaspekte
Die Sicherheitsaspekte dieser Chemikalien dürfen nicht unterschätzt werden. Perchlorsäure verätzt beispielsweise Haut und Gewebe sehr schwer, entsprechende Vorsicht ist also geboten.
Beispiele und Anwendungsfälle
Die Anwendungsbeispiele sind vielfältig: Sicherheitsstreichhölzer enthalten oft Kaliumchlorat, während Halogensauerstoffsäuren in Titrationen der analytischen Chemie essentiell sind. Pseudohalogene wie Cyanid werden zur Argentometrie herangezogen.
Die praktische Relevanz von Salzen der Halogensauerstoffsäuren wird beim IMPP gerne abgefragt, insbesondere deren Anwendung in analogen Verfahren wie der iodometrischen Titration.
Denke daran, dass das Verständnis dieser Konzepte nicht nur für das Bestehen deines Examens, sondern auch für deine spätere chemische Praxis unerlässlich ist.
Zusammenfassung
Feedback
Melde uns Fehler und Verbesserungsvorschläge zur aktuellen Seite über dieses Formular. Vielen Dank ❤️
Footnotes
Credits Struktur von Natriumhypochlorit Grafik: Benjah-bmm27, Sodium-hypochlorite, als gemeinfrei gekennzeichnet, Details auf Wikimedia Commons↩︎
Credits Struktur der Perchlorsäure Grafik: Jü, Perchloric acid Structural Formula V.1, als gemeinfrei gekennzeichnet, Details auf Wikimedia Commons↩︎
