Mesomerie
IMPP-Score: 1.8
Elektronenstruktur der lokalisierten und delokalisierten Bindungen
Chemische Bindungen lassen sich grundlegend in lokalisierte und delokalisierte Bindungen einteilen. Lokalisierte Bindungen sind solche, bei denen Elektronen zwei spezifischen Atomen zugeordnet werden können, wie beispielsweise in einer Sigma-Bindung (\(\sigma\)-Bindung), wo die Überlappung direkt zwischen zwei Atomkernen stattfindet. Delokalisierte Bindungen hingegen involvieren Elektronen, die sich über mehrere Atome oder einen ganzen Atomverbund erstrecken können. Ein klassisches Beispiel hierfür ist das \(\pi\)-Elektronensystem in Aromaten.
Mesomerie oder Resonanz
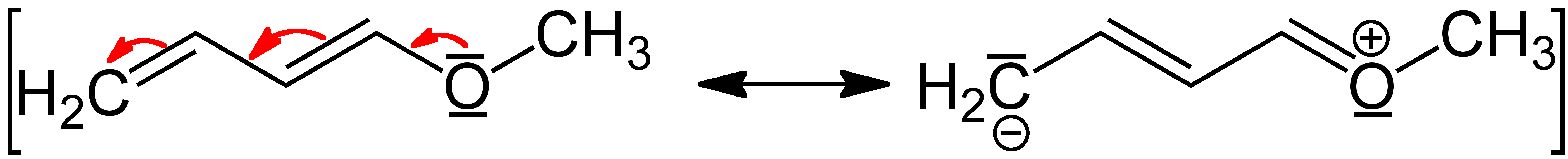
Die Mesomerie ist ein Konzept, das speziell die Delokalisierung von Elektronen in Molekülen beschreibt. Dabei werden zum Verständnis mehrere Grenzformeln gezeichnet, die verschiedene Möglichkeiten der Elektronenverteilung darstellen. Keine dieser Grenzformeln existiert für sich alleine, sondern die tatsächliche Struktur des Moleküls wird als Resonanzhybrid verstanden, wo die Elektronen über die beteiligten Atome verteilt sind.

Nicht jede Grenzformel stellt eine realistische Elektronenverteilung dar. Es ist entscheidend zu wissen, dass mesomere Grenzformeln:
- die Oktettregel beachten müssen (maximal acht Elektronen um ein Element der zweiten Periode),
- Atompositionen nicht verändern dürfen,
- alle Atome eine komplette Valenzschale aufweisen sollen.
Stabilisierung durch Mesomerie
Die Stabilität von Molekülen kann durch Mesomerie erhöht werden, weil die Elektronen über verschiedene Atome verteilt werden und so die Elektronendichte insgesamt ausgeglichener ist. Diese Verteilung der Elektronen führt unter anderem zu gleichmäßigen Bindungslängen, wie man es beim Benzolring sieht, wo alle C-C-Bindungen identisch sind.
Das IMPP fragt besonders gerne nach mesomeriestabilisierten Ionen und deren Bedeutung für die Reaktivität organischer Moleküle. Versteht gut, wie Delokalisierung zu Stabilität führt!
Mesomerie und Stabilität von Ionen
Sowohl Anionen als auch Kationen können durch Mesomerie stabilisiert werden. Das Acetat-Ion etwa wird durch Delokalisierung der negativen Ladung über beide Sauerstoffatome stabilisiert. Bei Carbeniumionen trägt die Delokalisierung der positiven Ladung über mehrere Atome zur Stabilisierung bei. Gleiches gilt für Radikale, wie das Triphenylmethylradikal, bei dem die delokalisierten Elektronen die Stabilität des Radikals erhöhen.
Auch Anionen profitieren von der Mesomerie. Bei der Deprotonierung einer Säure entsteht ein Anion, das durch die Delokalisierung der negativen Ladung im Molekül stabilisiert wird. Dies ist besonders ausgeprägt bei Sulfonsäuren, bei denen die negative Ladung über die Sulfongruppe verteilt wird.
Einfluss von Mesomerie auf Säure-Base-Eigenschaften
Mesomerie wirkt sich auch auf die Acidität und Basizität von Verbindungen aus. Wenn eine Verbindung ein Proton verliert und das dadurch entstehende Anion die negative Ladung durch Mesomerie verteilen kann, erhöht sich die Acidität der Ausgangsverbindung. Ein Beispiel hierfür ist der Acetaldehyd, bei dem die Mesomeriestabilisierung des Anions durch Delokalisierung über die \(\pi\)-Bindung die Acidität erhöht.
Die Acidität einer organischen Verbindung wird durch die Stabilität des resultierenden Anions nach dem Verlust eines Protons bestimmt. Verbindungen wie Acetessigsäureester zeigen durch die Delokalisierung von Elektronen im Anion eine erhöhte Acidität. In ähnlicher Weise verringern mesomere Effekte die Basizität von Verbindungen wie Anilin, indem sie das freie Elektronenpaar am Stickstoffatom delokalisieren und somit dessen Fähigkeit zur Protonenaufnahme reduzieren.
Mesomerie und Substituenteneffekte
Substituenten können mesomere Effekte induzieren, die als -M-Effekt (mesomerer Effekt, der Elektronendichte wegzuziehen scheint) und +M-Effekt (mesomerer Effekt, der zusätzliche Elektronendichte einführt) bekannt sind. Diese spielen beispielsweise eine große Rolle bei der Bewertung der Acidität von Phenolderivaten, wo eine Mesomerie-fähige Gruppe in para-Position die Acidität durch Elektronendelokalisierung erhöhen kann.
Das IMPP fragt besonders gerne nach der Rolle von Mesomerie bei Säure-Base-Reaktionen und der Stabilität von Ionen. Verstehe, wie Delokalisierung funktioniert, und sei in der Lage, die Effekte von Substituenten auf mesomere Strukturen einzuschätzen.
Mesomerie versus Tautomerie
Es ist wichtig, Mesomerie nicht mit Tautomerie zu verwechseln. Bei der Tautomerie werden Atome und Elektronen umgelagert, was zwei verschiedene Strukturen mit unterschiedlichen Verbindungen ergibt, während bei der Mesomerie nur Elektronen verschoben werden und die Atomanordnung gleich bleibt.
Mesomerie in Reaktionsmechanismen
Die Delokalisierung spielt auch in Reaktionsmechanismen eine Rolle, wie bei der Nitrierung von Benzol, wo ein \(\pi\)-Komplex als Zwischenstufe notwendig ist. In solchen Mechanismen stabilisiert Mesomerie reaktive Zwischenprodukte, was für das Verständnis organischer Reaktivität und Stabilität unerlässlich ist.
Praktische Beispiele und Implikationen
- Furan und Tetrazol zeigen eine erhöhte Stabilität durch Delokalisierung, die auch von freien Elektronenpaaren unterstützt wird.
- Carbeniumionen können beispielsweise bei einer SN1-Reaktion an einem Benzylkohlenstoff oder bei der Addition an eine Doppelbindung neben einem aromatischen Ring durch Mesomerie stabilisiert werden.
Verstehen und Anwenden solcher Konzepte werden dir helfen, die Eigenschaften und Reaktivitäten von Molekülen zu bestimmen und sind zentral für ein erfolgreiches Examen zum Thema organische Chemie.
Zusammenfassung
Feedback
Melde uns Fehler und Verbesserungsvorschläge zur aktuellen Seite über dieses Formular. Vielen Dank ❤️
Footnotes
Credits Mesomere Grenzstrukturen von Carbonat Grafik: Benjah-bmm27, Carbonate-ion-resonance-2D, als gemeinfrei gekennzeichnet, Details auf Wikimedia Commons↩︎
Credits Beispiel für einen mesomeren Effekt Grafik: Jü, Mesomeric effect (+M) V.1, als gemeinfrei gekennzeichnet, Details auf Wikimedia Commons↩︎
