Radikalische Substitution
IMPP-Score: 1
Radikalische Substitution: Definition und Mechanismen
Die radikalische Substitution ist eine grundlegende Reaktion in der organischen Chemie, bei der Atome oder Gruppen in einem Molekül durch Radikale ersetzt werden. Diese Reaktionsart spielt eine wichtige Rolle in der Synthesechemie sowie bei vielen biologischen und industriellen Prozessen.
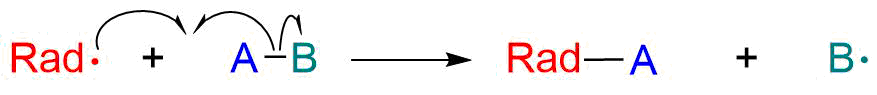
Initiation der Radikalbildung
Die Reaktion beginnt mit der Initiation, deren klassische Methode die Einwirkung von UV-Licht ist. UV-Licht liefert die Energie, um die homolytische Bindungsspaltung zu ermöglichen und damit Radikale zu erzeugen. Zum Beispiel führt die Bestrahlung von Chlor mit UV-Licht zur Bildung von Chlorradikalen:
\[ \text{Cl}_2 \xrightarrow{UV} 2 \cdot \text{Cl} \]
Alternativ lassen sich Peroxide wie Dibenzoylperoxid oder Azoverbindungen wie Azoisobutyronitril als Radikalstarter nutzen. Sie zerfallen unter milden Bedingungen und generieren auf diese Weise Radikale, die die Kette starten können:
\[ \text{R-O-O-R} \xrightarrow{\Delta} 2 \cdot \text{R-O} \]
Kettenfortpflanzung und Kettenabbruch
Im Zuge der Kettenfortpflanzung reagieren diese Radikale weiter und bilden unter Substitution eines Wasserstoffatoms neue Radikale, die den Zyklus fortsetzen. Zum Beispiel:
\[ \cdot \text{Cl} + \text{R-H} \rightarrow \text{R} \cdot + \text{HCl} \]
Der Kettenabbruch erfolgt, wenn zwei Radikale aufeinandertreffen und eine stabile Verbindung bilden, was das Ende der Reaktionskette bedeutet:
\[ \cdot \text{Cl} + \text{R} \cdot \rightarrow \text{R-Cl} \]
Stabilität und Reaktivität von Radikalen
Radikale werden durch verschiedene Effekte stabilisiert, was ihre Reaktivität maßgeblich beeinflusst.
Die Stabilität eines Radikals hängt von der Art seiner Substituenten ab. Tertiäre Radikale sind stabiler als sekundäre oder primäre, denn sie sind durch Hyperkonjugation und induktive Effekte stabilisiert. Allyl- und Benzylradikale profitieren zudem von der zusätzlichen Stabilität durch Resonanzstabilisierung.
Selektivität und Regioselektivität in der radikalischen Substitution
Radikalische Substitutionen zeigen eine deutliche Selektivität. Halogene wie Chlor und Brom demonstrieren eine höhere Selektivität für tertiäre C-Atome. Der Grund ist, dass tertiäre Alkylradikale stabiler sind und damit reaktiver als ihre sekundären und primären Gegenstücke. Tertiäre Radikale sind durch den +I-Effekt und durch mehr Hyperkonjugation stabilisiert.
Energetische Betrachtungen
Eine hohe Selektivität in radikalischen Reaktionen hängt oft mit ihren energetischen Übergangszuständen zusammen. Energetisch frühe Übergangszustände führen zu geringerer Selektivität, da Unterschiede zwischen konkurrierenden Reaktionswegen minimal sind. Die Iodierung von Alkanen ist ein Beispiel für eine radikalische Substitution, die energetisch ungünstig ist.
Anwendungsbeispiele
- Sandmeyer-Reaktion: Die Umsetzung aromatischer Amine zu Halogenaromaten unter Verwendung von Kupfer(I)-salzen.
- Anti-Markownikow-Orientierung: Die Addition von Halogenwasserstoffen an Alkene, wobei das Halogenatom an das weniger substituierte Kohlenstoffatom addiert wird.
Bei der radikalischen Addition entstehen Anti-Markownikow-Produkte, ein wichtiger Mechanismus, den das IMPP gerne abfragt.
- Wohl-Ziegler-Reaktion: Eine spezialisierte Bromierung in Allylstellung.
Radikalische Substitution unter verschiedenen Bedingungen
Radikale können nur unter bestimmten Bedingungen wirksam gebildet werden. UV-Licht ist oft erforderlich, um Radikale zu initiieren. Unter Ausschluss von Licht ist die radikalische Substitution weniger relevant.
Zusammenfassung
Feedback
Melde uns Fehler und Verbesserungsvorschläge zur aktuellen Seite über dieses Formular. Vielen Dank ❤️
Footnotes
Credits Mechanismus der radikalischen Substitution Grafik: Tanevala, Radical substitution, CC BY-SA 4.0↩︎
