Doppelbindungen
IMPP-Score: 1
Einführung in Doppelbindungen: σ- und π-Bindungen
Doppelbindungen sind ein zentrales Konzept in der organischen Chemie. Sie werden als Doppelbindungen bezeichnet, weil sie aus zwei Komponenten bestehen: einer σ-Bindung (Sigma-Bindung) und einer π-Bindung (Pi-Bindung). Eine σ-Bindung entsteht aus der Überlappung zweier Atomorbitale entlang der Bindungsachse und ist für die grundlegende Bindung zwischen den Atomen verantwortlich. Die π-Bindung hingegen ergibt sich aus der seitlichen Überlappung von p-Orbitalen, die sich über und unter der Bindungsachse erstrecken.
Doppelbindungen sind kürzer und stabiler als Einfachbindungen wegen der stärkeren orbitalen Überlappung, die eine σ- und eine π-Bindung verursacht. Zugleich sind sie wegen der π-Bindung weniger flexibel und erlauben keine Rotation um die Bindungsachse.
Bindungsparameter und räumliche Struktur
Die räumliche Struktur von Molekülen mit Doppelbindungen wird stark von der Hybridisierung der Atome in der Doppelbindung beeinflusst. Alkene, beispielsweise Ethen, haben sp2-hybridisierte Kohlenstoffatome, die mit einer trigonal planaren Anordnung und Bindungswinkeln von etwa 120° einhergehen. Diese Geometrie erklärt, warum Moleküle mit Doppelbindungen eine eingeschränkte Rotation und damit die Möglichkeit geometrischer Isomere (cis/trans oder E/Z) haben, was bei Einfachbindungen nicht der Fall ist.
Hybridisierung und Molekülgeometrie
sp2-Hybridisierung bei Alkenen
Alkene, wie Ethen und 1,3-Butadien, enthalten Kohlenstoffatome, die sp2-hybridisiert sind, was bedeutet, dass ein s-Orbital und zwei p-Orbitale zu drei sp2-Orbitalen hybridisiert werden, die in einer Ebene angeordnet sind. Eine verbleibende p-Orbital bleibt unhybridisiert und steht senkrecht zur Ebene, bereit für die Bildung der π-Bindung.
Es ist essenziell zu verstehen, dass sp2-hybridisierte Atome eine trigonal planare Anordnung mit einem Winkel von ungefähr 120° aufweisen. Dieses Wissen hilft dabei, die Struktur von Alkenen und ihre räumliche Anordnung zu verstehen.
Beispiele und Reaktivität von Doppelbindungen
Doppelbindungen in Ethen und Benzol
Im Benzol unterscheidet sich die Doppelbindung dadurch, dass die π-Bindungen über alle sechs Kohlenstoffatome delokalisiert und somit gleichmäßig über das Ring-System verteilt sind. Dadurch ergibt sich eine Bindungslänge, die zwischen der einer typischen Einfach- und Doppelbindung liegt.
Reaktivität von Alkenen
Bei der Reaktion von Alkenen wie Cyclohexen mit Elektrophilen ist Vorsicht geboten, da Elektrophile an die π-Bindung angreifen und zu einer Vielzahl von Produkten führen können. Im Falle von Cyclohexen und Dichlorcarben kann das Endprodukt ein Cyclopropan-Derivat sein.
E/Z-Isomerie bei Doppelbindungen
Die E/Z-Isomerie ist ein Ergebnis der Einschränkung der Rotation um die Doppelbindung und tritt auf, wenn unterschiedliche Substituenten an den Kohlenstoffatomen der Doppelbindung vorhanden sind. Diese Isomere unterscheiden sich in ihren physikalischen und chemischen Eigenschaften.
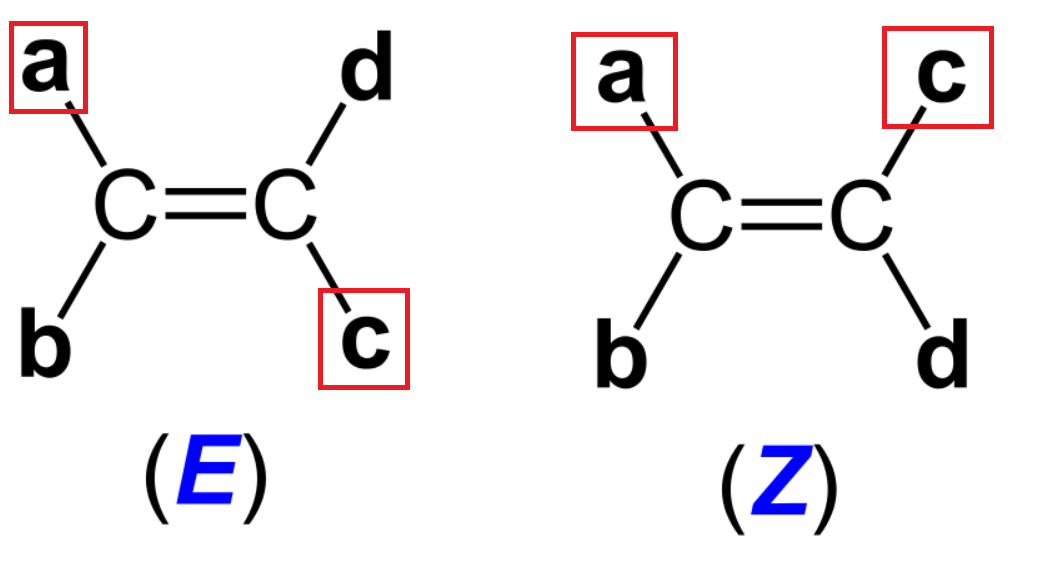
Das IMPP fragt besonders gerne nach Isomerieverhältnissen bei Doppelbindungen. Deshalb ist es wichtig, dass du die räumliche Struktur und die Substituenten verstehen und E/Z-Isomere identifizieren kannst.
Zusammenfassung
Feedback
Melde uns Fehler und Verbesserungsvorschläge zur aktuellen Seite über dieses Formular. Vielen Dank ❤️
Footnotes
Credits Struktur der Doppelbindung Grafik: I, Amelliug, Liaison pi, CC BY-SA 3.0↩︎
Credits EZ-Nomenklatur Grafik: Jü, (Z)-Alkene V.1, CC0 1.0↩︎
