Säure-Base-Reaktion
IMPP-Score: 1.7
Die Protolyse von Salzen und wie sie den pH-Wert beeinflussen
Um die Protolyse von Salzen und ihre Auswirkung auf den pH-Wert zu verstehen, müssen wir analysieren, wie sich die verschiedenen Ionen in Wasser verhalten. Dazu schauen wir uns an, wie Salze aus der Kombination von Säuren und Basen entstehen und wie diese Salze dann mit Wasser reagieren.
Protolyse von Neutralsalzen
Bei Salzen, die aus Kationen starker Basen und Anionen starker Säuren entstehen, passiert bei der Auflösung in Wasser etwas Interessantes – oder besser gesagt, nicht viel! Diese Salze, wie zum Beispiel das aus Natronlauge (eine starke Base) und Perchlorsäure (eine starke Säure) gebildete Natriumperchlorat, reagieren in Wasser neutral. Das bedeutet, dass solche Salze weder die Konzentration von \(H_3O^+\) noch von \(OH^-\) in der Lösung nennenswert verändern und der pH-Wert sich nicht weit von 7 entfernt.
Protolyse von Salzen schwacher Basen und starker Säuren
Bei Salzen, die sich aus einer starken Säure und einer schwachen Base zusammensetzen, fungieren die Kationen nach der Auflösung in Wasser oft als Lewis-Säuren. Sie neigen dazu, \(H_2O\)-Moleküle zu koordinieren und dadurch die \(H_3O^+\)-Konzentration zu erhöhen. Das führt letztendlich zu einem sauren pH-Wert der Lösung. Ein typisches Beispiel hierfür sind Salze mit Kationen wie \(Al^{3+}\) oder \(Fe^{3+}\).
Salze von Kationen schwacher Basen und Anionen starker Säuren können den pH-Wert senken, da die Kationen als Lewis-Säuren wirken und die \(H_3O^+\)-Konzentration erhöhen.
Protolyse von Salzen starker Basen und schwacher Säuren
Im Gegensatz dazu, wenn Salze aus einer starken Base und einer schwachen Säure stammen, sind die Anionen der schwachen Säure dazu fähig, sich mit Wasser zu verbinden und dabei \(OH^-\)-Ionen zu bilden. Das führt zur Bildung einer alkalischen Lösung. Ein Beispiel ist Natriumhydrogencarbonat (\(NaHCO_3\)), bei dem das \(HCO_3^-\)-Ion mit Wasser reagiert und \(OH^-\) bildet:
\[ NaHCO_3 + H_2O \rightarrow H_2CO_3 + OH^- + Na^+ \]
Das Kation, hier \(Na^+\), ist “neutral” im Sinne der Säure-Base-Chemie, da es aus einer starken Base (Natriumhydroxid) stammt und keine signifikante Wirkung auf den pH-Wert hat.
Ampholytische Substanzen in Wasser
Ampholyte sind Substanzen, die sowohl als Säuren als auch als Basen fungieren können. In Wasser können sie also je nach Situation Protonen abgeben oder aufnehmen. Diese Fähigkeit zur Amphoterie ist wichtig für Substanzen wie Aminosäuren oder bestimmte Salzionen wie \(HPO_4^{2-}\). Je nach Reaktionsbedingungen und den vorliegenden Konzentrationen anderer Ionen können Ampholyte den pH-Wert in beide Richtungen beeinflussen.
Ampholyte wie Aminosäuren können abhängig vom pH-Wert der Umgebung entweder Protonen aufnehmen und als Base wirken oder Protonen abgeben und als Säure fungieren.
pH-Wert und Protolyse
Der pH-Wert einer Lösung, definiert als der negative Logarithmus der \(H_3O^+\)-Ionen-Konzentration, wird direkt durch die Protolyse der gelösten Säuren und Basen beeinflusst. Eine vollständige Dissoziation einer starken Säure erhöht die \(H_3O^+\)-Konzentration und senkt damit den pH-Wert, während schwache Säuren und Basen sowie deren Salze zu weniger ausgeprägten Änderungen führen.
In Bezug auf die Prüfung könnt ihr vom IMPP Fragen zu spezifischen Szenarien erwarten, bei denen ihr bestimmen sollt, ob eine Lösung sauer, neutral oder alkalisch reagiert, abhängig von den Protolyseeigenschaften der Komponenten des gelösten Salzes.
Es könnte zum Beispiel gefragt werden, warum eine Lösung von Ammoniumchlorid (\(NH_4Cl\)) sauer reagiert. Hier müsst ihr wissen, dass das \(NH_4^+\) aus einer schwachen Base (Ammoniak) stammt und das Chlorid-Ion keinen Einfluss hat, da es aus der starken Säure HCl stammt. Das Ammonium-Ion gibt in Wasser ein Proton ab und senkt somit den pH-Wert der Lösung.
Zusammenhang von pKs-Wert, pKb-Wert und pH-Wert
Ein tiefes Verständnis von den pKs- und pKb-Werten ist wichtig, um vorherzusagen, wie ein Salz in Wasser reagiert. Diese Werte geben an, wie stark eine Säure Protonen abgeben oder eine Base Protonen aufnehmen kann. Sie beeinflussen direkt die Reaktion des Salzes in Wasser und damit die Veränderung des pH-Wertes.
Bei der Erstellung von Pufferlösungen oder der Berechnung des pH-Wertes einer Lösung sind die pKs- und pKb-Werte der beteiligten Säure-Base-Paare von entscheidender Bedeutung.
Autoprotolyse
Autoprotolyse ist ein wesentliches Konzept der Säure-Base-Chemie, welches beschreibt, wie reine Lösungsmittel wie Wasser selbst Protonen übertragen können. Das klassische Beispiel hierfür ist das Wasser selbst, welches sich in Hydronium- (\(\text{H}_3\text{O}^+\)) und Hydroxid-Ionen (\(\text{OH}^-\)) aufteilt:
\[\text{2 H}_2\text{O} \leftrightarrow \text{H}_3\text{O}^+ + \text{OH}^-\]
Diese Reaktion zeigt, dass ein Wassermolekül als Säure fungiert, indem es ein Proton abgibt, während das andere als Base agiert, indem es dieses Proton aufnimmt. Dieser Prozess ist wichtig für das Verständnis von pH-Werten und der Eigenschaften von Lösungsmitteln.
Beachte, dass es sich bei der Autoprotolyse um die Protonenübertragung zwischen identischen Molekülen handelt. Es ist also ein klarer Unterschied zu Reaktionen, bei denen Protonen zwischen unterschiedlichen Substanzen ausgetauscht werden.
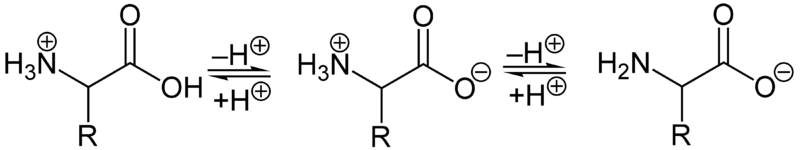
Ampholyte
Ampholyte sind Stoffe, die sowohl als Säuren als auch als Basen reagieren können. Ein bekanntes Beispiel für Ampholyte sind Aminosäuren, die einerseits Protonen an die Aminogruppe abgeben und andererseits Protonen an die Carboxylgruppe aufnehmen können:
\[\text{R-CH(NH}_3^+)(\text{COO}^-) + \text{H}_2\text{O} \leftrightarrow \text{R-CH(NH}_2)(\text{COOH}) + \text{H}_3\text{O}^+ \leftrightarrow \text{R-CH(NH}_2)(\text{COO}^-) + \text{OH}^-\]
Wasser selbst ist ein Ampholyt, der in Reaktionen sowohl als Säure als auch als Base agieren kann. Dieses Verhalten ist entscheidend für das Verständnis, wie gewisse Salze sich in wässrigen Lösungen verhalten und wie Pufferlösungen funktionieren.
Verhältnis von konjugierten Säure-Base-Paaren
Bei einer Säure-Base-Reaktion entstehen immer konjugierte Säure-Base-Paare. Dazu gehört das Paar einer Säure und ihrer konjugierten Base nach Abgabe eines Protons (Deprotonierung) sowie das Paar einer Base und ihrer konjugierten Säure nach Aufnahme eines Protons (Protonierung).
Das IMPP fragt besonders gerne nach dem Verständnis von konjugierten Säure-Base-Paaren. Wichtig ist, die generelle Regel zu verinnerlichen:
Eine starke Säure hat eine schwache konjugierte Base, während eine schwache Säure eine relativ starke konjugierte Base besitzt. Dies gilt umgekehrt auch für Basen und ihre konjugierten Säuren.
Beispiele:
- Salzsäure (\(\text{HCl}\)) ist eine starke Säure und bildet das konjugierte Base-Paar \(\text{Cl}^-\), welches nur eine sehr schwache Base ist.
- Essigsäure (\(\text{CH}_3\text{COOH}\)) ist eine schwache Säure, und ihr konjugiertes Base-Paar \(\text{CH}_3\text{COO}^-\) ist eine stärkere Base.
Dieses Konzept hilft nicht nur dabei, das pH-Verhalten von Lösungen zu verstehen, sondern auch Vorgänge zu erklären, bei denen Ionen in Lösung gehen und mit dem Wasser reagieren, was zur Bildung von sauren oder basischen Lösungen führen kann.
Zusammenfassung
Feedback
Melde uns Fehler und Verbesserungsvorschläge zur aktuellen Seite über dieses Formular. Vielen Dank ❤️
Footnotes
Credits Aminosäuren während einer Säure-Base-Titration Grafik: Jürgen Martens, Amino acid titration, CC BY-SA 3.0↩︎
