Weitere stickstoffhaltige Verbindungsklassen
IMPP-Score: 4.3
Die Klassen stickstoffhaltiger organischer Verbindungen und ihre wichtigsten Reaktionsmechanismen
Stickstoffhaltige Verbindungen spielen in der organischen Chemie eine zentrale Rolle und kommen in einer Fülle unterschiedlicher Strukturen und Funktionalitäten vor, die spezifische Eigenschaften und Reaktivitäten aufweisen. Wenn das IMPP nach den Reaktionsmechanismen stickstoffhaltiger Verbindungen fragt, konzentriert es sich oft auf die Wege, über die sich diese Verbindungen bilden oder umsetzen lassen. In diesem Abschnitt sollen die wichtigsten Klassen und Reaktionen beschrieben werden.
Diazoniumsalze und ihre Reaktionen
Diazoniumsalze sind charakterisiert durch ihre typische funktionelle Gruppe, das Diazonium-Ion (\(R-N_2^+\)). Sie haben eine hohe Bedeutung in der synthetischen Chemie, insbesondere für die Herstellung von aromatischen Verbindungen.
Die Herstellung von Diazoniumsalzen erfolgt häufig durch die Reaktion von Anilin mit salpetriger Säure, wodurch Stickstoff freigesetzt wird. In der Wärme oder mittels wässrigem Medium zersetzen sich diese Salze leicht, sodass oft Phenole entstehen.
Ein gängiges Beispiel ist die Umwandlung von Anilin in ein Diazoniumsalz, welches dann in Phenole überführt werden kann. Die dafür erforderliche nucleophile Substitution führt oft zur Abspaltung von Stickstoff, einem gut messbaren Gas, das sich zur einfachen Verifizierung der Reaktion eignet.
Beispiel: Die Umsetzung eines aromatischen Diazoniumsalzes mit Wasser resultiert unter Abspaltung von Stickstoff in der Bildung eines Phenols.
Gabriel-Synthese für primäre Amine
Die Gabriel-Synthese dient der Herstellung von primären Aminen und verwendet Phthalimid als Ausgangsmaterial. In einem zweistufigen Prozess findet zuerst die Alkylierung statt, gefolgt von einer Hydrazinolyse.
Wichtig ist die sequentielle Natur der Gabriel-Synthese: Nach der Alkylierung des Phthalimids wird das Produkt durch die Behandlung mit Hydrazin in das freie primäre Amin überführt.
Hydrazinbasierte Verbindungen und Heterocyclensynthesen
Hydrazin und dessen Derivate sind Präkursoren für viele Synthesen von Heterocyclen. Sie können viele Reaktionen eingehen, einschließlich Kondensation, Reduktion und Umlagerung.
Beispiel: Die Umsetzung von Hydrazin mit Diketonen ermöglicht die Synthese von Pyrazol-Ringen.
Hydrazin wird häufig in Kondensationsreaktionen verwendet, insbesondere wenn es um die Synthese stickstoffhaltiger Ringe geht.
Spezifität und Stabilisierung
Diazoniumsalze werden durch Aromaten stabilisiert, was ihre Anfälligkeit gegenüber Wärme und Licht in gewissem Maße reduziert.
Die Stabilisierung durch Aromaten ist entscheidend für das Verhalten von Diazoniumsalzen, insbesondere wenn es darum geht, ihre Reaktionsbereitschaft zu kontrollieren.
Basizität von Amidinen
Amidine sind stickstoffhaltige Verbindungen mit einer Basizität, die höher ist als die von herkömmlichen Aminen. Diese erhöhte Basizität resultiert aus einer Mesomeriestabilisierung des Amidiniumions.
Amidiniumionen sind durch Mesomerie-Effekte stabilisiert, was zu einer erhöhten Basizität dieser Stoffklasse führt. Es ist wichtig, den Einfluss von Struktur und Resonanz auf die Basizität zu verstehen.
Weiterführende stickstoffhaltige Verbindungsklassen
Imide
Die Imide sind bedeutende Verbindungsklassen, die durch zwei Carbonylgruppen gekennzeichnet sind, die an ein Stickstoffatom gebunden sind. Ihre Struktur erlaubt die Delokalisierung der negativen Ladung nach Deprotonierung, was sie acider macht als Amide.
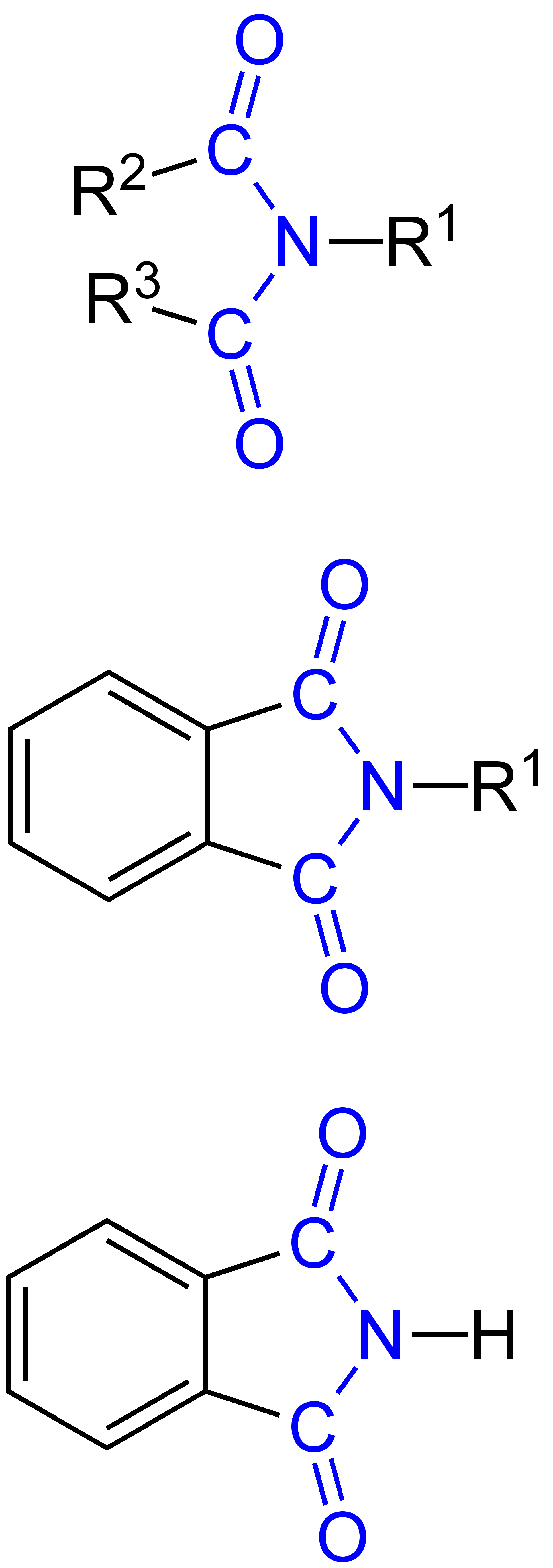
In Prüfungen werden gerne die resonanzstabilisierten Strukturen der Imide nach Deprotonierung abgefragt.
Hydroxylamine
Hydroxylamine sind Verbindungen, in denen eines der Wasserstoffatome eines Amins durch eine Hydroxylgruppe ersetzt ist. Die funktionelle Gruppe lautet -NH\(_2\)OH. Hydroxylamine sind wichtig für die Synthese von Isoxazolen und spielen eine Rolle bei der Oximierung von Ketonen.
Imidazole
Imidazole sind ein zentraler Bestandteil vieler biologisch aktiver Moleküle. Sie besitzen ein Fünferring-System mit zwei Stickstoffatomen. Wichtig für das IMPP ist die Tatsache, dass Imidazole in der Lage sind, tautomer zu sein und dass ihr Stickstoffatom in der Synthese als Nukleophil agieren kann.
Azoverbindungen
Azoverbindungen zeichnen sich durch die Gruppe -N=N- aus und sind für die Bildung von Farbstoffen relevant, da sie oft farbig sind. Die N=N-Doppelbindungen können als Elektrophile in Reaktionen mit Nukleophilen eingehen.
Cyanide
Cyanide enthalten die Gruppe -C\(\equiv\)N und sind wegen ihrer starken Bindung und ihrer Umsetzung zum Nitril von großer Bedeutung. Sie dienen häufig als Stickstoffquelle in der organischen Synthese, etwa in der Benzoin-Kondensation oder der Strecker Synthese.
Azide
Azide zeichnen sich durch die Präsenz der -N3-Gruppe aus. Diese hochenergetische und reaktive funktionelle Gruppe ist bekannt für ihre Beteiligung an 1,3-dipolaren Cicloadditionen.
Isocyanate
Isocyanate enthalten die Gruppierung -N=C=O und sind zentral in der Herstellung von Polyurethanen. Sie bilden sich beispielsweise durch thermisches Umlagern von Carbonsäureaziden.
Nitrosamine
Nitrosamine mit der funktionellen Gruppe -N(NO)-R sind aufgrund ihrer mutagenen und kanzerogenen Eigenschaften wichtig in der Toxikologie. Sie entstehen oft in einer Nitrosierung von sekundären Aminen.
Oxime
Oxime besitzen die funktionelle Gruppe >C=N-OH und entstehen durch die Reaktion von Ketonen oder Aldehyden mit Hydroxylamin.
Guanidine
Guanidine mit der funktionellen Gruppe >C(=NH)NH2 sind starke Basen und wichtig für viele organische Synthesen.
Carbodiimide
Carbodiimide (-N=C=N-) sind an Peptidsynthesen beteiligt und wirken als Dehydratisierungsmittel, um Wassermoleküle aus einer Reaktion zu entfernen.
Reaktionsfähigkeit: Nucleophile und Acidität/Basizität
Die nucleophile Reaktivität dieser Verbindungen ist vielfältig. Imide und Imidazole beispielsweise können als Nukleophile in synthetischen Reaktionen agieren, wobei stets die Resonanzstruktur und Elektronendichte zu beachten sind. Cyanide sind wegen ihrer Fähigkeit, am Kohlenstoff oder Stickstoff zu reagieren (ambidentes Verhalten), besonders interessant.
Das IMPP fragt besonders gerne nach Reaktionen mit organischen Cyaniden und deren vielseitigen Einsatzmöglichkeiten in der Synthese.
Zusammenfassung
Feedback
Melde uns Fehler und Verbesserungsvorschläge zur aktuellen Seite über dieses Formular. Vielen Dank ❤️
Footnotes
Credits Die allgemeine Struktur von Diazoniumsalzen, hier am Beispiel eines Diazoniumchlorids. Grafik: MaChe, FunktionelleGruppen Diazoniumsalze, als gemeinfrei gekennzeichnet, Details auf Wikimedia Commons↩︎
Credits Gabriel-Synthese: Überblick Grafik: Дёрте Вилкен, Gabriel Synthese 1 Überblick4, als gemeinfrei gekennzeichnet, Details auf Wikimedia Commons↩︎
Credits Die Struktur von Imiden. Grafik: Jü, Imide Group General Formulae V.1, als gemeinfrei gekennzeichnet, Details auf Wikimedia Commons↩︎
