Lösungen
IMPP-Score: 1.2
Lösungsenthalpie und Gitterenthalpie
Beim Lösen eines Feststoffs in einem Lösungsmittel sprechen wir von der Lösungsenthalpie, die den Energieumsatz in diesem Prozess beschreibt. Diese Enthalpieänderung resultiert aus zwei Hauptkomponenten: der Gitterenergie des Feststoffs und der Energie, die durch die Wechselwirkungen zwischen Festkörper und Lösungsmittel – oft als Solvatationsenthalpie bezeichnet – umgesetzt wird.
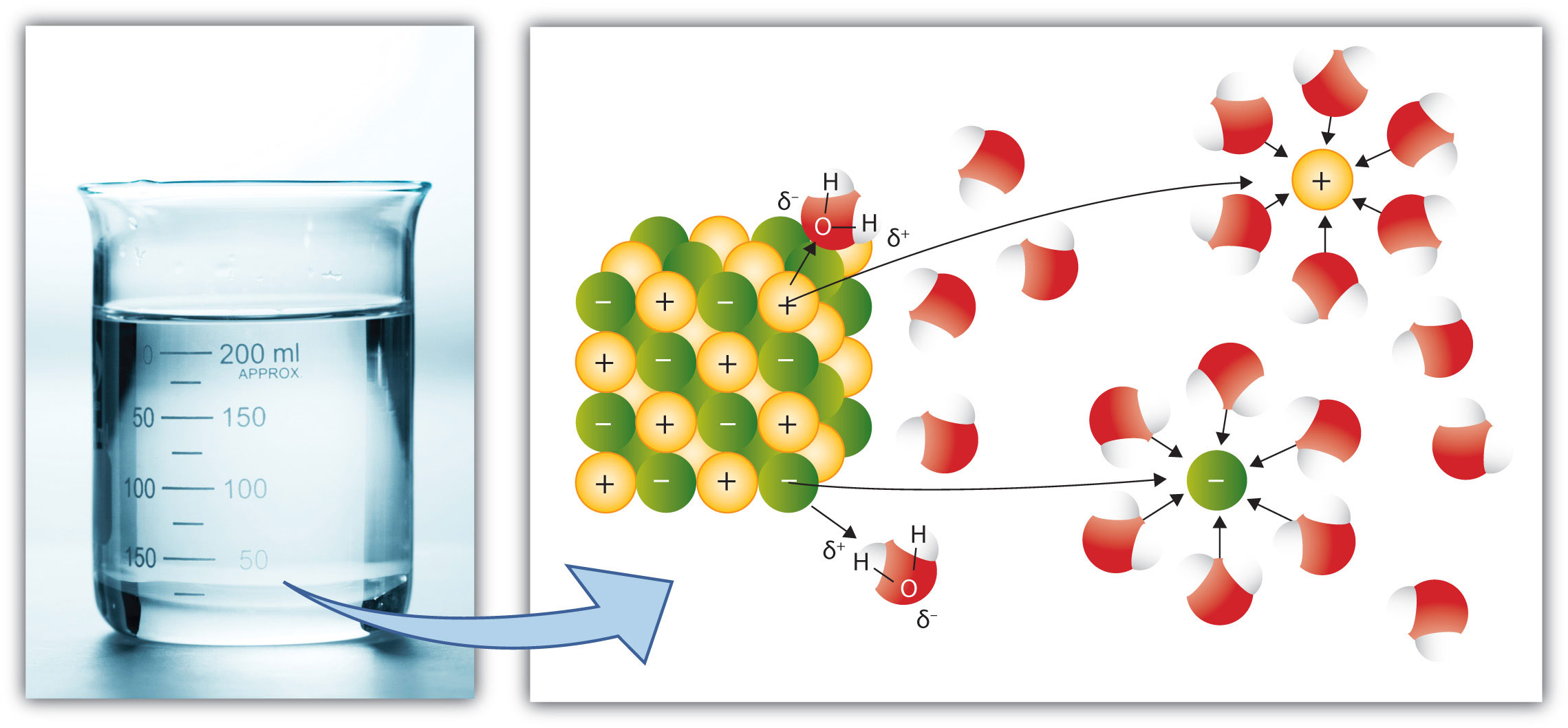
Die Gitterenthalpie ist ein Maß für die Energiemenge, die benötigt würde, um einen Kristall vollständig in seine einzelnen, gasförmigen Ionen zu zerlegen. Sie reflektiert die Stärke der Bindungen im Kristallgitter und ist ein wichtiger Faktor zur Beurteilung der Stabilität eines Kristalls.
Beim Lösen von kristallinen Feststoffen in Lösungsmitteln oder bei Reaktionen, die Festkörper einschließen, spielt die Gitterenthalpie eine entscheidende Rolle. Verstehe die Konzepte rund um Kristallisations- und Gitterenthalpie, denn das IMPP sieht hier gerne Fragen.
Gitterenergie vs. Solvatationsenthalpie
Die Gitterenergie ist ein Maß für den Energieaufwand, den es kostet, das Kristallgitter des Feststoffs zu überwinden – wir müssen also Energie zuführen, um die Ionen aus ihrem stabilen Verbund zu lösen. Im nächsten Schritt werden diese Ionen vom Lösungsmittel, zum Beispiel Wasser, stabilisiert, was wir als Solvatation kennen (oder als Hydratation, wenn es sich konkret um Wasser handelt). In diesem Schritt wird meist Energie freigesetzt, da neue, stabilisierende Wechselwirkungen zwischen den Ionen und den Lösungsmittelmolekülen entstehen.
Das IMPP fragt besonders gerne nach der Lösungswärme, wenn es darum geht zu verstehen, warum ein Prozess exo- oder endotherm ist. Wichtig ist hierbei, dass ihr die Richtung der Energien beachtet: Eine positive Lösungsenthalpie bedeutet, dass Energie aufgenommen wird (endothermer Prozess), während eine negative Lösungsenthalpie eine Energieabgabe (exothermer Prozess) anzeigt.
Temperaturabhängigkeit
Die Lösungsenthalpie ist temperaturabhängig, weil die kinetische Energie der Teilchen und somit ihr Wechselwirkungspotenzial von der Temperatur beeinflusst wird. So kann sich bei verschiedenen Temperaturen durchaus unterscheiden, ob der Lösungsprozess Energie aufnimmt oder abgibt.
Beispiel: Das Auflösen von Salzen
Betrachten wir beispielsweise die Auflösung von AgF in Wasser: Die Gitterenergie muss hierbei überwunden werden, und die Solvatationsenthalpie gibt Energie frei. Ist die freigesetzte Energie bei diesem Vorgang größer als die benötigte Energie zum Überwinden der Gitterenergie, sprechen wir von einer negativen Lösungsenthalpie – der Vorgang ist exotherm, die Lösung erwärmt sich.
Solvatation und Hydratation
Wassermoleküle stabilisieren gelöste Ionen durch ihre polare Natur. Die Solvatation beinhaltet die Umhüllung der Ionen mit Lösungsmittelmolekülen.
Mechanismus der Solvatation
Beim Lösen in Wasser orientieren sich die Wassermoleküle so um die Ionen, dass die entgegensetzte Partialladung gegenüber den Ionen liegt (der positiv geladene Teil zum Anion, der negativ geladene Teil zum Kation). Der Prozess wird speziell für Wasser als Hydratation bezeichnet und führt zur Bildung von Hydrathüllen.
In dem Bild wird ein Natriumion gezeigt, welches sich erfolgreich aus dem Kristallgitter herausgelöst hast und von den Dipolen der Wassermoleküle umgeben ist.
Dipolmoment und Dielektrizitätszahl
Das Dipolmoment und die Dielektrizitätszahl von Wasser sind entscheidend für diesen Prozess. Wasser hat eine hohe Dielektrizitätszahl, was erklärt, warum es so gut Ionen solvatisieren kann – es verringert effektiv die elektrostatische Anziehung zwischen den Ionen und ermöglicht so deren Trennung im wässrigen Medium.
Löslichkeit
Die Löslichkeit eines Ions in Wasser wird von der Gitterenthalpie und der Hydratationsenthalpie bestimmt. Ionen mit großer Ladungsdichte, wie kleine, hochgeladene Ionen, haben oft eine große Hydratationsenthalpie und damit eine hohe Löslichkeit.
Die IMPP-Fragen zielen oft darauf ab, die Temperaturabhängigkeit der Löslichkeit zu verstehen. Merkt euch, dass eine steigende Temperatur die Löslichkeit erhöhen oder vermindern kann, abhängig von den Verhältnissen der beteiligten Enthalpien.
Kolligative Eigenschaften
Die kolligativen Eigenschaften einer Lösung umfassen Siedepunktserhöhung, Gefrierpunktserniedrigung und osmotischen Druck. Sie sind abhängig von der Anzahl, aber nicht von der Art der gelösten Teilchen.
Grundprinzip kolligativer Eigenschaften
Hier spielt es keine Rolle, was gelöst ist, sondern lediglich wie viel davon in der Lösung vorhanden ist. Das hilft zum Beispiel dabei, die Molekularmasse eines gelösten Stoffes über die gemessenen Änderungen der kolligativen Eigenschaften zu bestimmen.
Bedeutung für physiologische Vorgänge
Die genannten Prinzipien sind nicht nur im Reagenzglas wichtig, sondern spielen auch in biologischen Systemen eine große Rolle. So sind die Osmose und die auf kolligativen Eigenschaften basierenden Druckverhältnisse in Zellen essentiell für die Homöostase im menschlichen Körper.
Im Examen wird häufig gefragt, wie sich Löslichkeit und kolligative Eigenschaften in biologischen Kontexten auswirken. Denkt dabei an die Osmoregulation und wie die Löslichkeit von Gasen in Körperflüssigkeiten zum Gasexchange und zur Zellatmung beiträgt.
Bei der Vorbereitung für euer Examen denkt daran, die Konzepte nicht nur auswendig zu lernen, sondern versteht die zugrunde liegenden Prinzipien und wie sie miteinander in Beziehung stehen. Beispiele können dabei helfen, das Gelernte zu verinnerlichen.
Zusammenfassung
Feedback
Melde uns Fehler und Verbesserungsvorschläge zur aktuellen Seite über dieses Formular. Vielen Dank ❤️
Footnotes
Credits Lösungsvorgang Grafik: Andy Schmitz, Sodium chloride dissolution, CC BY 3.0↩︎
Credits Gelöstes Natriumion Grafik: Original: Dr. Steven P. Berg Vector: Duncan Keall, Glrx, JoKalliauer,, Na+H2O, als gemeinfrei gekennzeichnet, Details auf Wikimedia Commons↩︎
