Allgemeines
IMPP-Score: 1
Allgemeines zu Edelgasen und ihre Bedeutung
Edelgase - das sind die chemischen Elemente Helium (He), Neon (Ne), Argon (Ar), Krypton (Kr), Xenon (Xe) und Radon (Rn). Sie bilden die 18. Gruppe des Periodensystems und sind für ihre geringe Reaktivität bekannt.

Entdeckung und Vorkommen
Die Entdeckung der Edelgase begann Ende des 19. Jahrhunderts, und sie zeichnen sich durch einige besondere Eigenschaften aus, welche die Forschung bis heute faszinieren. In der Natur kommen sie vor allem in der Atmosphäre vor, aber teils auch in Mineralien oder als Produkt radioaktiver Zerfälle.
Chemische und physikalische Eigenschaften
Alle Edelgase haben vollständig besetzte Elektronenschalen, was bedeutet, dass ihr äußerstes Elektronenniveau (s und p Orbitale) keine zusätzlichen Elektronen aufnehmen kann. Helium hat als Ausnahme nur eine vollständig gefüllte s-Schale mit zwei Elektronen. Diese Elektronenkonfiguration führt dazu, dass die Atome extrem reaktionsträge sind.
Die Ionisierungsenergie ist ein Maß dafür, wie stark ein Elektron an den Atomkern gebunden ist. Bei Edelgasen ist diese Energie besonders hoch, was die Entfernung von Elektronen schwieriger macht und die geringe Reaktivität erklärt.
Besonderheiten von Argon und Xenon
Argon (Ar) ist das häufigste Edelgas in unserer Atmosphäre. Es ist nicht nur äußerst reaktionsträge, sondern hat aufgrund seines Vorkommens auch viele praktische Anwendungen gefunden, wie das Schutzgas in der Schweißtechnik. Argon hat eine sehr geringe Elektronegativität und bildet keine Oxide mit Sauerstoff.
Xenon (Xe) zeigt uns, dass Edelgase unter bestimmten Bedingungen doch reagieren können. Mit stark elektronegativen Partnern wie Fluor bildet es stabile Verbindungen. Diese Fähigkeit von Xenon, sich anders zu verhalten als andere Edelgase, eröffnet interessante chemische Forschungsmöglichkeiten.
Gewinnung und technische Nutzung
Edelgase gewinnt man vorrangig durch fraktionierte Destillation verflüssigter Luft. Dabei nutzt man die unterschiedlichen Siedepunkte der Gase, um sie voneinander zu trennen. Helium gewinnt man häufig aus Erdgasquellen, da es bei der radioaktiven Zerfallsreihe von Uran und Thorium entsteht.
Die Nutzung von Edelgasen ist vielfältig:
- Helium wird in der Kältetechnik eingesetzt und findet in Luftschiffen Verwendung, weil es viel leichter als Luft ist.
- Neon beleuchtet in Leuchtröhren die Straßen bei Nacht.
- Argon dient als Inertgas beim Schweißen und in Glühlampen.
- Xenon wird in der Medizin als Anästhetikum verwendet und beleuchtet als Edelgasentladungslampe die Straßen.
Physikalische Eigenschaften
Edelgase besitzen im Vergleich zu anderen Elementen niedrige Siede- und Schmelzpunkte - am niedrigsten bei Helium. Dies liegt an den vergleichsweise schwachen van-der-Waals-Kräften, die zwischen den einzelnen Gasatomen wirken, da es keine permanenten Dipole gibt.
Siede- und Schmelztemperaturen
Die Schmelzpunkte und die Siedepunkte steigen innerhalb der Edelgase vom Helium zum Radon an. Radon halt also den höchsten Schmelzpunkt während Helium den kleinsten Schmelzpunkt hat.
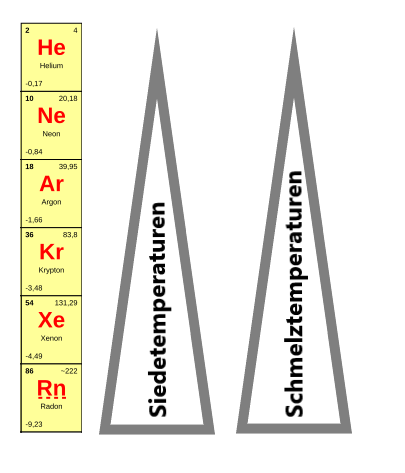
Grund hierfür sind die mit der steigenden Elektronenhülle auch stärker werdenden Van-der-Waals-Kräfte. Stärkere Wechselwirkungen zwischen den Teilchen sorgen dann dafür, dass die Gase mehr Energie in Form von Temperaturerhöhungen brauchen, bis sie sieden bzw. schmelzen.
Dichte im Vergleich zu Luft und Anwendungen
Die Dichte der Edelgase ist ebenfalls ein wichtiger Punkt. Helium z.B. ist wesentlich leichter als Luft, was es für das Befüllen von Ballons oder Luftschiffen prädestiniert.
Die Suprafluidität von Helium bei extrem niedrigen Temperaturen ist ein faszinierendes Phänomen. Zudem sind Edelgase nicht brennbar, was sie für Anwendungen in Bereichen mit hoher Brandgefahr interessant macht.
Rolle in Wissenschaft und Industrie
Das IMPP fragt besonders gerne nach der Reaktionsträgheit und den sicheren Anwendungen der Edelgase. Darüber hinaus solltet ihr die physikalischen Eigenschaften wie Siedepunkte und Dichten sowie die besonderen Fälle von reaktiveren Edelgasen wie Xenon im Auge behalten.
Edelgase sind aufgrund ihrer einzigartigen Eigenschaften nicht mehr aus Wissenschaft und Industrie wegzudenken. Sie zeigen uns, wie die Natur ihre ganz eigenen Wege geht und wie wir diese Besonderheiten für uns nutzen können.
Zusammenfassung
Feedback
Melde uns Fehler und Verbesserungsvorschläge zur aktuellen Seite über dieses Formular. Vielen Dank ❤️
Footnotes
Credits Illustration der Edelgase Grafik: New work Alchemist-hpwww.pse-mendelejew.de); original single images: Jurii, http://images-of-elements.com., Glowing noble gases, CC BY 3.0↩︎
Credits Schmelzpunkte bei den Edelgasen Grafik: Mrmw, Periodensystem newdraft, bearbeitet von MK, CC0 1.0↩︎
