Metallorganische Verbindungen
IMPP-Score: 2.6
Die Rolle von Grignard-Reagenzien in der organischen Synthese
Grignard-Reagenzien, benannt nach dem französischen Chemiker Victor Grignard, der 1912 den Nobelpreis für die Entdeckung dieser Verbindungen erhielt, sind eine Klasse metallorganischer Verbindungen, die in der organischen Chemie eine bedeutende Rolle spielen. Ein Grignard-Reagenz wird formal aus einem Alkyl- oder Arylhalogenid und Magnesiummetall hergestellt und hat die allgemeine Formel \(RMgX\), wobei \(R\) ein organischer Rest (wie Methyl oder Phenyl) und \(X\) ein Halogen (wie Brom oder Iod) ist. Sie dienen als mächtige Nukleophile und Reagenzien in einer Vielzahl von Synthese-Reaktionen.
Herstellung von Grignard-Reagenzien
Die Herstellung von Grignard-Reagenzien ist relativ einfach, erfordert aber sorgfältige Technik, um Feuchtigkeit und Luft auszuschließen, da diese das Reagenz zersetzen können. Die Reaktion erfolgt in einem aprotischen Lösungsmittel wie Diethylether oder THF, wobei metallisches Magnesium mit dem Alkyl- oder Arylhalogenid umgesetzt wird.
\[ R-X + Mg → RMgX \]
Die Reaktionsgefäße müssen komplett trocken sein und ein Inertgas (z.B. Argon) wird oft verwendet, um Luft und Feuchtigkeit auszuschließen.
Reaktivität und Reaktionen von Grignard-Reagenzien
Grignard-Reagenzien sind sowohl starke Basen als auch starke Nukleophile. Dies führt dazu, dass sie mit einer breiten Palette elektrophiler Moleküle reagieren können, was sie zu zentralen Akteuren in der organischen Synthese macht.
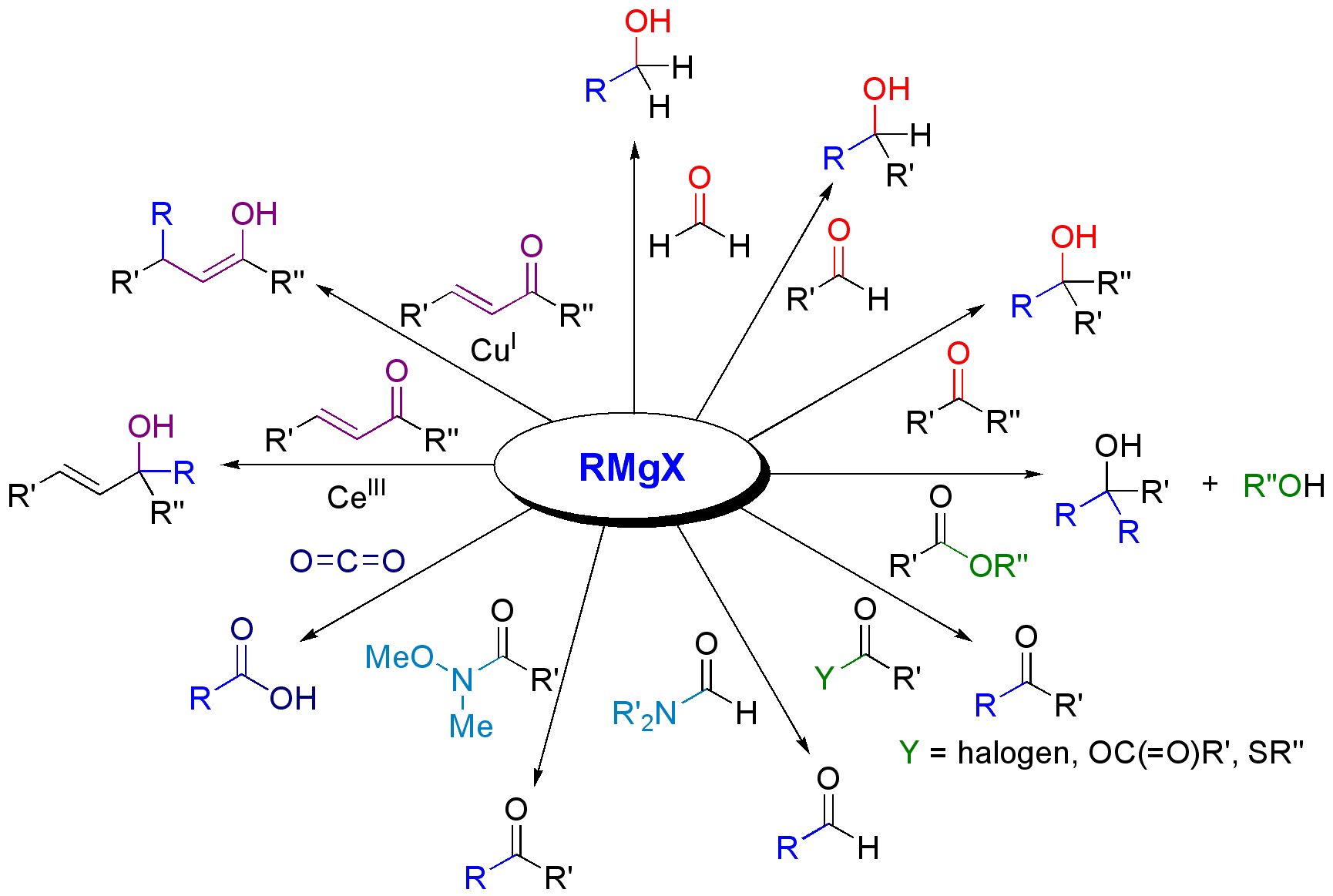
Die Wichtigsten Reaktionstypen sind:
Addition an Carbonylverbindungen: Grignard-Reagenzien reagieren mit Aldehyden und Ketonen unter Bildung von Alkoholen nach anschließender Protonierung.
\[ RMgX + R'CHO → R'R"CHOH \] \[ RMgX + R'COR'' → R'R"R'''COH \]
Reaktion mit Kohlendioxid: Sie reagieren mit \(CO_2\) unter Bildung von Carbonsäuremagnesiumsalzen, die nach saurer Aufarbeitung als freie Carbonsäuren vorliegen.
\[ RMgX + CO_2 → RCOOMgX \] \[ RCOOMgX + H^+ → RCOOH + MgX^+ \]
Umwandlung von Nitrilen in Ketone: Nach der Reaktion der Grignard-Verbindung mit einem Nitril und anschließender Hydrolyse entsteht ein Keton.
\[ RMgX + R'C≡N → R'RC(=O)MgX \] \[ R'RC(=O)MgX + H_2O → R'RCO + Mg(OH)X \]
Reaktionen mit Ester: Hierbei entstehen tertiäre Alkohole, wenn das Stöchiometrieverhältnis 2:1 Grignard-Reagenz zu Ester beträgt.
\[ 2 RMgX + R'COOR'' → R'R"R'''COH \]
Wasser, Alkohole und Carbonsäuren: Hierbei werden Grignard-Verbindungen zerstört, was zur Bildung der entsprechenden Kohlenwasserstoffe führt.
\[ RMgX + H_2O → RH + Mg(OH)X \]
Sensitivität gegenüber Feuchtigkeit und übliche Fallstricke
Aufgrund ihrer Reaktivität sind Grignard-Reagenzien extrem feuchtigkeitssensitiv. Schon geringe Mengen Wasser oder Alkohol können sie zersetzen und ihre Reaktivität beeinträchtigen. Daher ist ein trockenes Arbeitsumfeld unerlässlich.
Feuchtigkeit ist der Feind eines jeden Grignard-Reagenzes. Sogar die Feuchtigkeit in der Luft kann bereits genug sein, um die Reaktion zu beeinträchtigen.
Aufarbeitungsschritte bei Grignard-Reaktionen
Nach einer Grignard-Reaktion müssen die Produkte meist aufgearbeitet werden, um die gewünschten organischen Verbindungen zu isolieren. Typische Aufarbeitungsschritte beinhalten die Neutralisation von überschüssigem Grignard-Reagenz, gefolgt von der Säure-Base-Aufarbeitung, um das Produkt zu protonieren und zu extrahieren. Oft wird auch das nicht reaktive Magnesiumsalz durch Filtration oder durch Zugabe von Säuren als schwerlösliches Magnesiumhydroxid entfernt.
Eigenschaften und Reaktionen von lithiumorganischen Verbindungen
Lithiumorganische Verbindungen sind eine bedeutende Klasse von metallorganischen Verbindungen, die im Bereich der Synthese wegen ihrer Reaktivität häufig verwendet werden. Besonders das IMPP legt Wert darauf, dass du die Reaktionen und Eigenschaften dieser Verbindungen genau verstehst, da sich daraus oft prüfungsrelevante Fragen entwickeln.
Herstellung von lithiumorganischen Verbindungen
Die Herstellung von lithiumorganischen Verbindungen erfolgt in der Regel durch Umsetzung von Halogenalkanen (z. B. Chlorbutan oder Brommethan) mit metallischem Lithium. Hierbei wird die Halogen-Lithium-Bindung geknüpft. Diese Umsetzungen müssen unter Feuchtigkeitsausschluss stattfinden, da lithiumorganische Verbindungen mit Wasser heftig reagieren und dabei das entsprechende Alkan freisetzen würden.
Struktur und Polarität von Organolithiumverbindungen
Die Struktur von Organolithiumverbindungen ist durch eine signifikante Polarität der Kohlenstoff-Lithium-Bindung geprägt. Lithium, mit einer geringen Elektronegativität, überlässt dem Kohlenstoffatom im Wesentlichen die Bindungselektronen. Dies hat zur Folge, dass das Kohlenstoffatom ein starkes Nukleophil ist, das bereit ist, an elektrophile Zentren anzugreifen.
Die Polarität beeinflusst die Reaktionsfähigkeit von Organolithiumverbindungen und deren Reaktion mit Elektrophilen.
Basizität von Organolithiumverbindungen
Organolithiumverbindungen sind sehr starke Basen. Ihre Basizität ist stark von der Natur des organischen Restes abhängig. Tertiäre Butyllithium-Verbindungen z. B. sind basischer als n-Butyllithium aufgrund der induktiven Effekte der Alkylgruppen, was bedeutet, dass sie bei der Deprotonierung von Molekülen effektiver sein können.
Verwendung von Lithiumaluminiumhydrid (LiAlH4)
LiAlH4 ist ein starkes Reduktionsmittel, das häufig verwendet wird, um Carbonsäurederivate zu reduzieren. Dies gilt sowohl für Amide, die zu Aminen reduziert werden, als auch für Ester, die zu den entsprechenden Alkoholen reduziert werden.
LiAlH4 ist extrem reaktiv gegenüber Wasser, daher erfolgen alle Reaktionen unter absolut wasserausschließenden Bedingungen.
Selektivität und Reaktivität in Synthesereaktionen
Ein Schlüssel zum Erfolg in der organischen Synthese ist die Steuerung der Reaktivität und Selektivität von Reagenzien. In der Verwendung von Organolithiumverbindungen ist es wichtig zu erkennen, dass sie nicht nur nucleophil, sondern teilweise so basisch sind, dass sie vorsichtig eingesetzt werden müssen, um Nebenreaktionen wie Deprotonierungen zu vermeiden.
Anwendung und Reaktivität spezieller metallorganischer Verbindungen
Bei der Vorbereitung auf das Examen ist es außerordentlich wichtig, nicht nur die Grundlagen metallorganischer Verbindungen zu kennen, sondern auch deren spezifische Anwendungen und Reaktionen zu verstehen. Dieses Wissen unterscheidet oft zwischen einem grundlegenden Verständnis und der Fähigkeit, komplexere Zusammenhänge zu erfassen, die das IMPP gerne prüft.
Ziegler-Natta-Katalysatoren
Ziegler-Natta-Katalysatoren spielen eine entscheidende Rolle in der modernen chemischen Industrie, besonders bei der Polymerisation von Olefinen wie Ethylen, um hochmolekulares Polyethylen zu erzeugen. Diese Katalysatoren bestehen meist aus Titanverbindungen in Verbindung mit Alkylaluminium und erlauben die Polymerisation bei niedrigen Drücken, was ein kosteneffektives Verfahren darstellt.
Die Ziegler-Natta-Polymerisation ist wirtschaftlich enorm bedeutend, da sie es ermöglicht, Polymere mit sehr exakter Molekularstruktur zu erzeugen.
Metallorganische Kupfer-, Eisen-, Palladium- und Titanverbindungen
Kupferverbindungen
In der organischen Synthese sind Lithiumorganocuprate (z.B. Lithiumdimethylcuprat) nützlich, um an α,β-ungesättigte Carbonylverbindungen in einer 1,4-Addition das Alkylfragment anzufügen. Dadurch können vielfältige Synthesen durchgeführt werden, die ohne diese Verbindungen schwerfällig oder gar nicht möglich wären.
Eisenverbindungen
Eine besondere Eisenverbindung ist Ferrocen, ein “Sandwich”-Komplex, bestehend aus zwei Cyclopentadienyl-Anionen, die ein Eisenatom einschließen. Es dient beispielsweise in der organischen Chemie als Ausgangsstoff für viele weitere Synthesen und sogar in der Medizin als Wirkstoffträger.
Palladiumverbindungen
Palladiumkomplexe sind zentral für die Durchführung von Kreuzkupplungsreaktionen, die in der organischen Synthese für die Bildung von Kohlenstoff-Kohlenstoff-Bindungen unerlässlich sind. Eine klassische Reaktion ist die Suzuki-Kupplung, bei der Palladium oxidative Additionen, Transmetallierungen und reduktive Eliminierungen durchführt.
Das IMPP fragt besonders gerne nach dem Mechanismus und der Rolle von Palladiumkomplexen in Kreuzkupplungsreaktionen.
Beschäftige dich insbesondere mit den Katalysatoreigenschaften von Metallverbindungen wie Ziegler-Natta-Katalysatoren sowie mit den Anwendungen von metallorganischen Kupfer-, Eisen-, Palladium- und Titanverbindungen in der organischen Synthese.
Zusammenfassung
Feedback
Melde uns Fehler und Verbesserungsvorschläge zur aktuellen Seite über dieses Formular. Vielen Dank ❤️
Footnotes
Credits Die Grignard-Reaktion Grafik: Дёрте Вилкен, Grignard Reaktion Übersicht2, als gemeinfrei gekennzeichnet, Details auf Wikimedia Commons↩︎
Credits Die verschiedenen Grignard-Reaktionen Grafik: Calvero., Grignard with carbonyl, als gemeinfrei gekennzeichnet, Details auf Wikimedia Commons↩︎
Credits BuLi Grafik: Jü, N-BuLi Structural Formula V.1, als gemeinfrei gekennzeichnet, Details auf Wikimedia Commons↩︎
