Gleichgewichtszustand
IMPP-Score: 0.5
Kriterien für den Gleichgewichtszustand in chemischen Systemen
Der Begriff chemisches Gleichgewicht beschreibt einen Zustand, in dem eine chemische Reaktion nicht mehr scheinbar voranschreitet, da die Geschwindigkeiten von Hin- und Rückreaktion genau gleich sind. Dies bedeutet jedoch nicht, dass die Reaktionen aufhören – sie geschehen nur mit gleicher Rate in beide Richtungen, was zu konstanten Konzentrationen der Reaktanten und Produkte führt. Dieses Prinzip ist in der folgenden Grafik veranschaulicht:
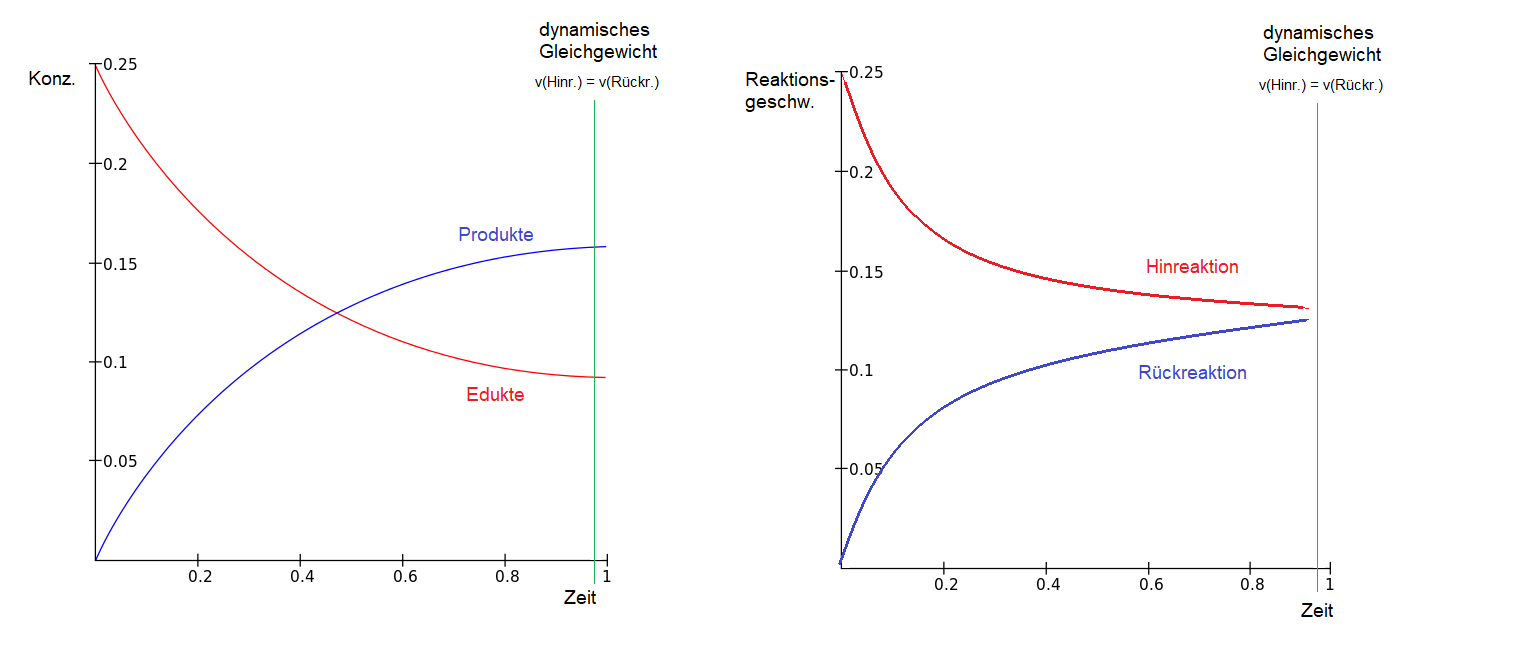
Das dynamische Wesen des Gleichgewichts
Man spricht vom dynamischen Gleichgewicht, weil trotz der Konstanz der Konzentrationen die einzelnen Reaktionsprozesse weiterhin stattfinden. Die Stoffe reagieren weiterhin miteinander, aber aufgrund der gleichen Geschwindigkeiten von Hin- und Rückreaktion resultiert keine beobachtbare Änderung im System.
Einfluss von Katalysatoren
Katalysatoren erhöhen die Reaktionsgeschwindigkeiten, indem sie die Aktivierungsenergie für die Reaktion herabsetzen. Sie beschleunigen sowohl die Hin- als auch die Rückreaktion und ermöglichen so eine schnellere Einstellung des Gleichgewichts, ohne jedoch die Gleichgewichtslage selbst zu verändern.
Thermodynamische Beschreibung
Die thermodynamische Beschreibung des Gleichgewichts erfolgt über die freie Enthalpie \(\Delta G\) und ihre Beziehung zur Gleichgewichtskonstanten \(K\) und zur Temperatur \(T\). Die wichtige Beziehung lautet:
\[\Delta G = -RT \ln K\]
Hier ist \(R\) die universelle Gaskonstante und \(T\) die absolute Temperatur. Diese Gleichung erklärt, dass bei \(\Delta G < 0\) die Reaktion spontan abläuft, bei \(\Delta G = 0\) sich das System im Gleichgewicht befindet und bei \(\Delta G > 0\) die Rückreaktion bevorzugt wird.
Metastabilität
Metastabilität beschreibt einen Zustand, in dem ein System stabil gegenüber kleinen Störungen ist, aber auf größere einwirkende Kräfte mit einer Reaktion reagieren kann. Es zeigt ein Gleichgewicht an, das nur scheinbar stabil ist und durch einen energetischen “Schubs” in eine andere Richtung gelenkt werden kann.
Relevanz in biologischen Systemen
In biologischen Systemen spielt das chemische Gleichgewicht eine zentrale Rolle bei der Regulierung von Stoffwechselvorgängen. Viele Prozesse im Organismus finden in einem dynamischen Gleichgewicht statt, das auch als Fließgleichgewicht bezeichnet wird, bei dem die Konzentrationen der Stoffe konstant gehalten werden, während kontinuierlich Materie durch das System strömt.
Das IMPP fragt besonders gerne nach der Bedeutung von Gleichgewichtskonzepten im Kontext biologischer Systeme und den Auswirkungen von äußeren Bedingungen auf die Gleichgewichtslage. Sei deshalb sicher, dass du das dynamische Wesen des Gleichgewichts und die Rolle der freien Enthalpie (\(\Delta G\)) gut verstehst.
Denke daran, dass diese Konzepte miteinander verbunden sind und das Verständnis der Gleichgewichtskriterien hilft, das Verhalten chemischer Systeme unter verschiedenen Bedingungen zu verstehen und vorherzusagen.
Zusammenfassung
Feedback
Melde uns Fehler und Verbesserungsvorschläge zur aktuellen Seite über dieses Formular. Vielen Dank ❤️
Footnotes
Credits Prinzip des chemischen Gleichgewichts Grafik: Fintelia, ChemicalEquilibrium, bearbeitet von MK, CC BY-SA 3.0↩︎
