Reaktive Zwischenstufen
IMPP-Score: 1.5
Reaktive Zwischenstufen in der Organischen Chemie
Reaktive Zwischenstufen spielen eine entscheidende Rolle in der organischen Chemie und sind essenziell zum Verständnis vieler Reaktionsmechanismen. Diese Zwischenstufen sind meist instabil und existieren nur für eine kurze Dauer während eines Reaktionsprozesses. Ihre Struktur, Stabilität und Reaktivität zu verstehen, ist für das Lösen von Examensfragen, wie sie das IMPP oft stellt, unabdingbar.
Radikale
Radikale sind Atome oder Moleküle, die ein oder mehrere ungepaarte Elektronen besitzen. Sie sind extrem reaktiv, weil sie bestrebt sind, ihr Elektronenoktett zu komplettieren. Die Bildung von Radikalen kann durch verschiedene Methoden wie Photolyse oder Redoxreaktionen erreicht werden. Ein klassisches Beispiel für das Verhalten von Radikalen ist eine radikalische Kettenreaktion, etwa die Halogenierung von Alkanen.
Die Stabilität eines Radikals beeinflusst dessen Reaktivität. Tertiäre Radikale sind stabiler als sekundäre, welche stabiler als primäre sind. Das Triphenylmethylradikal ist ein gutes Beispiel für ein durch Mesomerie stabilisiertes Radikal. Ebenso können induktive und hyperkonjugative Effekte Radikale stabilisieren.
Carbenium-Ionen (Carbokationen)
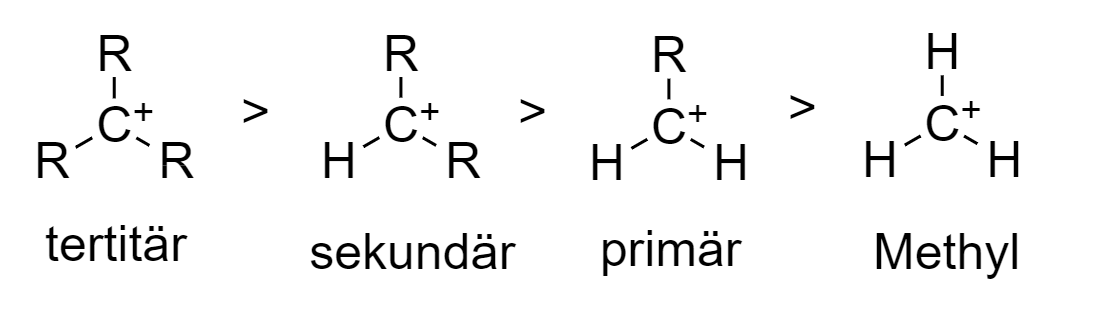
Ein Carbenium-Ion besitzt ein positiv geladenes Kohlenstoffatom und ist eine zentrale Zwischenstufe in vielen Reaktionen wie SN1-Reaktionen und bestimmten Eliminierungen. Tertiäre Carbenium-Ionen sind aufgrund des +I-Effekts von Alkylgruppen und der möglichen Mesomeriestabilisierung durch benachbarte π-Systeme stabiler als sekundäre und primäre Carbenium-Ionen.
Carbanionen
Carbanionen weisen am Kohlenstoffatom ein freies Elektronenpaar auf, das zu einer negativen Ladung führt. Die Stabilität kann durch mesomere Effekte erhöht werden, beispielsweise wenn das Kohlenstoffatom in einer Allyl- oder Benzylposition steht. Carbanionen sind nucleophile Intermediate in vielen Reaktionen, wie etwa in Aldolreaktionen.
Carbene und Nitrene
Carbene haben ein Kohlenstoffatom mit nur sechs Valenzelektronen, wodurch ein Elektronensextett entsteht. Sie sind reaktiv und spielen eine Rolle in Reaktionen wie der Bildung von Dichlorcarbene, einem Elektrophil, das mit Doppelbindungen reagiert.
Nitrene sind ähnlich energetisch aktiviert und können im Hofmann-Abbau von Aminen als Zwischenstufen auftauchen. Sie haben einen Elektronensextett-Charakter und sind für die Bildung von Isocyanaten relevant.
Bedeutung der Elektronenverteilung
Die Stabilität reaktiver Zwischenstufen hängt stark von der Verteilung von Elektronen ab. Elektronendichte, die über ein konjugiertes System verteilt ist, kann dazu führen, dass auch relativ instabile Intermediate wie benzylische oder allylische Kationen stabilisiert werden und einen aromatischen Charakter annehmen können.
Beispiele typischer Reaktionen mit reaktiven Zwischenstufen
- Die Bildung von Peroxiden aus Diethylether durch eine Radikalkettenreaktion ist ein klassisches Beispiel für die Reaktionsfähigkeit von Radikalen.
- Die Reaktion von Ethan mit einem Chlor-Radikal zeigt, wie durch homolytische Spaltung Radikale entstehen und weiter reagieren.
Unterscheidung von reaktiven Zwischenstufen und Übergangszuständen
Es ist wichtig, reaktive Zwischenstufen von Übergangszuständen zu unterscheiden. Während Zwischenstufen tatsächliche, isolierbare Spezies sein können, sind Übergangszustände nur theoretische Zustände auf dem Reaktionspfad zwischen Reaktanten und Produkten.
Reaktive Zwischenstufen wie Carbenium-Ionen, Radikale, Carbanionen und Carbene müssen klar von Übergangszuständen unterschieden werden. Insbesondere für SN1, E2, Radikalkettenreaktionen und elektrophile aromatische Substitutionen ist dieses Wissen essenziell.
Zusammenfassung
Feedback
Melde uns Fehler und Verbesserungsvorschläge zur aktuellen Seite über dieses Formular. Vielen Dank ❤️
Footnotes
Credits Mesomere Stabilisierung von Radikalen Grafik: Jü, Benzylic Mesomerism V.1, CC BY-SA 4.0↩︎
Credits Unterschiedliche Stabilität von Carbeniumionen Grafik: Autor unbekannt.↩︎
Credits Beispiel eines Carbanions Grafik: Jü, Carbanion Structural Formulae V.1, als gemeinfrei gekennzeichnet, Details auf Wikimedia Commons↩︎