Konformationsisomere
IMPP-Score: 1.2
Konformationsisomere in der organischen Chemie und Stereochemie
Die Stereochemie beschäftigt sich mit der räumlichen Anordnung von Atomen in Molekülen. Innerhalb dieses Gebiets sind Konformationsisomere – auch als Konformer oder Rotamere bekannt – von besonderer Bedeutung. Sie entstehen durch Rotation um Einfachbindungen und beeinflussen maßgeblich die physikalischen und chemischen Eigenschaften von Molekülen. Im Gegensatz zur Konfigurationsisomerie müssen bei der Konformationsisomerie keine Bindungen gebrochen werden; die verschiedenen Anordnungen können durch Rotation um Bindungen erreicht werden.
Newman-Projektion und Diederwinkel
Die Newman-Projektion ist besonders nützlich, um die räumliche Anordnung der Atome um eine bestimmte Bindung - üblicherweise eine C-C-Bindung - zu visualisieren. Man blickt direkt entlang der Bindungsachse und sieht die Substituenten entweder direkt auf sich zu oder von sich weg.
- Ein Kreis repräsentiert das hintere Atom, die darauf liegenden Striche oder Symbole stellen die Substituenten dieses Atoms dar.
- Das Atom, von dem aus man schaut, ist durch die Mitte des Kreises repräsentiert, mit den eigenen Substituenten als Strichen, die vom Kreis wegzeigen.
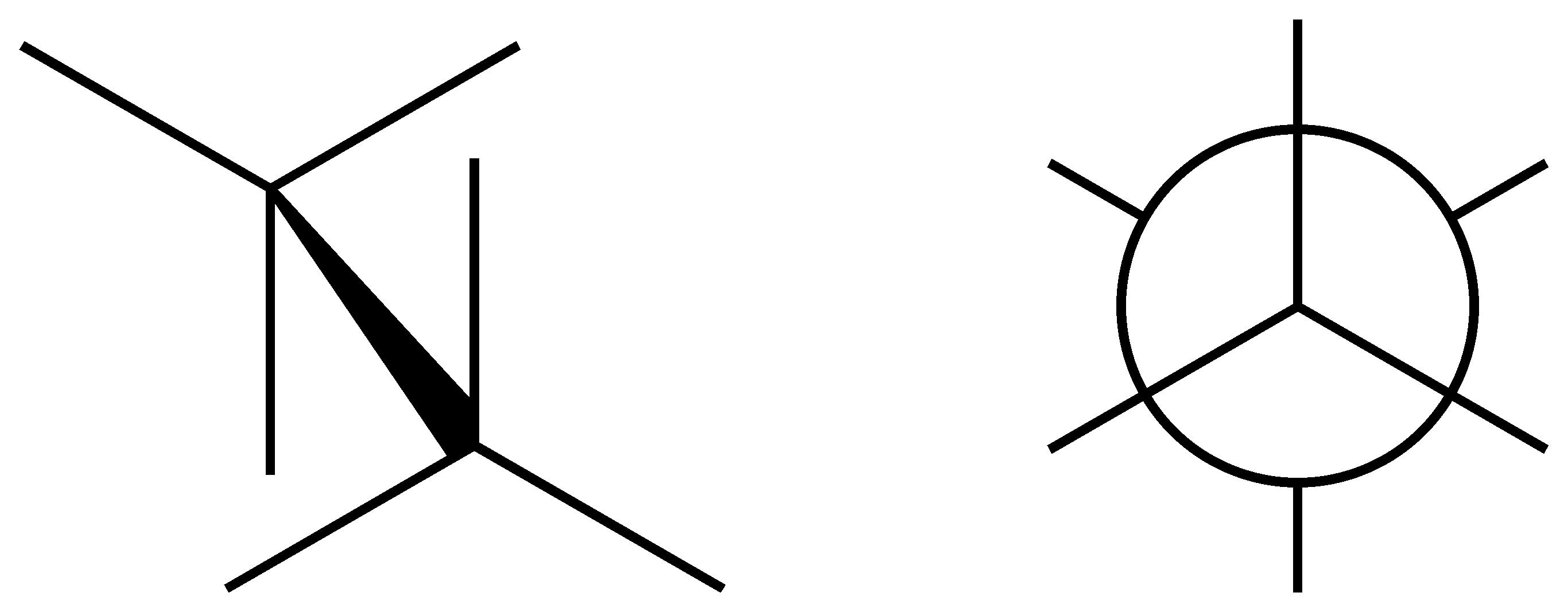
Besonders wichtig ist es, die Torsions- oder Diederwinkel zu verstehen und korrekt zu interpretieren, da sie essenziell sind für das Verständnis der Molekülgeometrie und der energetischen Beziehungen zwischen verschiedenen Konformeren.
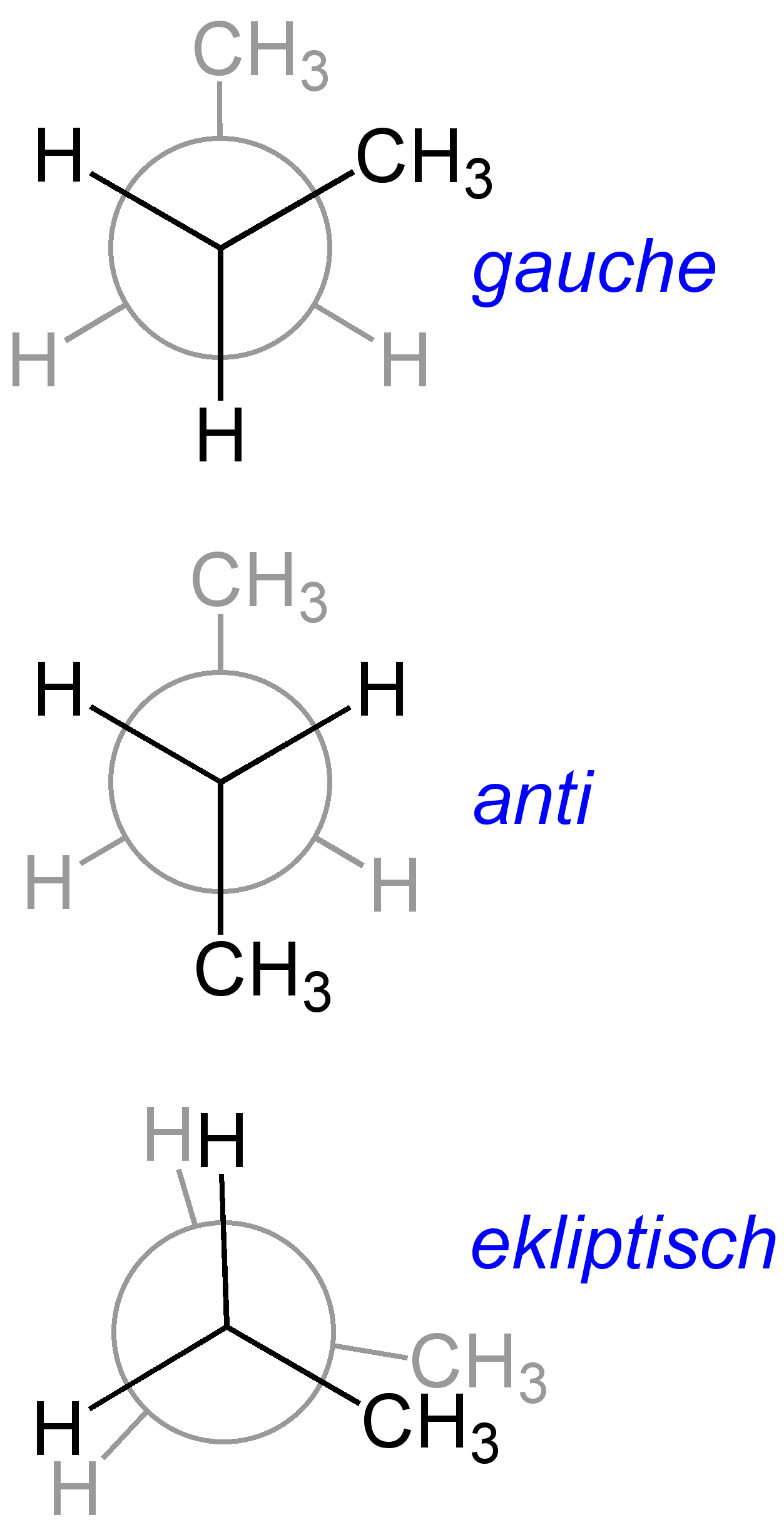
In Newman-Projektionen werden Konformationen wie gestaffelt (vertikale Substituenten der beiden verbundenen Atome maximieren den Abstand) und ekliptisch (vertikale Substituenten liegen direkt übereinander) unterschieden. Hierbei wird besonders die torsionale Spannung, die entsteht, wenn Substituenten zu nah beieinanderstehen (ekliptische Konformation), thematisiert.
Bei der Beschreibung der relativen Positionen von Substituenten in Newman-Projektionen aromatischer Verbindungen solltet ihr auf den korrekten Gebrauch der Begriffe aus der Klyne-Prelog-Konvention achten.
Rotationsbarrieren und Torsionsspannung
Wenden wir uns zunächst dem Butan zu, einem einfachen Beispiel, um die Konzepte von Konformationsisomeren zu veranschaulichen. Butan kann verschiedene Konformationen durch Rotation um die C-C-Bindung annehmen. Zur Klassifikation von Konformationsisomeren verwendet man dazu die Klyne-Prelog-Konvention. Diese nützliche Konvention erlaubt es, die räumliche Anordnung von Atomen in einem Molekül systematisch zu beschreiben und vorherzusagen, wie sich die Konformationsisomere eines Moleküls verhalten werden.
- Die gestaffelte Konformation ist die energetisch bevorzugte Anordnung, in der die Methylgruppen und deren Wasserstoffatome maximal voneinander gestaffelt sind, was zu einem Torsionswinkel von 180° führt. Diese Anordnung minimiert die sterische Hinderung.
- Im Gegensatz dazu ist die ekliptische Konformation energetisch ungünstiger. Hier überdecken die Methylgruppen direkt hintereinander bei einem Torsionswinkel von 0°. Die sterische Hinderung und elektrostatische Abstoßung sind in dieser Konformation maximal.
- Zwischen diesen beiden Extremen liegen die gauche- oder synklinale Konformationen, in denen benachbarte Methylgruppen um 60° oder 120° versetzt sind.
Das IMPP fragt besonders gerne nach dem Energieunterschied dieser Konformationen und der Bedeutung der Torsionsspannung. Für den Erfolg im Examen essentiell ist das Verständnis der verschiedenen Torsionswinkel:
- Syn-periplanar oder ekliptisch (0°): Die Substituenten stehen direkt übereinander und maximieren die Abstoßung.
- Anti-periplanar oder gestaffelt (180°): Die Substituenten sind so weit wie möglich voneinander getrennt, was zu einer reduzierten Abstoßung und zu einer stabilen Anordnung führt.
- Synklinale oder gauche (60° und 120°): Hier sind die Substituenten nicht direkt hintereinander, aber auch nicht maximal gestaffelt. Sie bieten einen Kompromiss zwischen sterischer Hinderung und Abstoßung.
Mit einem soliden Verständnis dieser Aspekte bist du bestens auf Fragen zu Konformationsisomeren und Stereochemie im Examen vorbereitet.
Energetisches Profil von Konformationsisomeren
Jede Konformation eines Moleküls besitzt ein spezifisches Energieprofil. Die Kenntnis solcher Profile ist entscheidend, denn sie erlauben Vorhersagen über die Stabilität und das Verhalten von Molekülen. In einem Energieprofil wären die gestaffelten Konformationen die Minima, während die ekliptischen Konformationen mit den höchsten Energiepunkten korrespondieren.
Cyclohexan und seine Konformere
Nun zum Cyclohexan. Dieses Molekül ist berühmt für seine Sessel- und Wannenkonformation. Die Sesselkonformation ist die energetisch günstigere, da sie die geräumigste ist und Substituenten mehr Platz bietet, um Interaktionen zu minimieren. Im Gegensatz dazu ist die Wannenkonformation energetisch ungünstiger, da hier die Substituenten räumlich enger beieinander liegen.
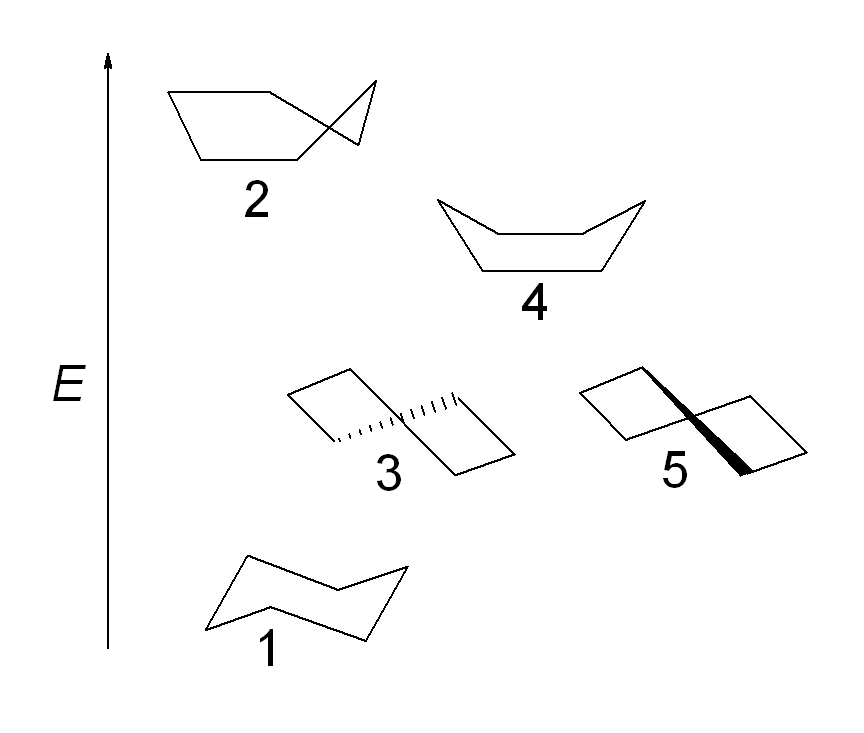
Die Sesselkonformation ist aufgrund der minimierten sterischen Hinderungen und Torsionsspannungen am stabilsten Die Sesselkonformation hat zwei Typen von Positionen für Substituenten, axial und äquatorial. In der Regel bevorzugen Substituenten die äquatoriale Position, um sterische Spannungen zu vermeiden.
Es ist sehr hilfreich, wenn du dir das Cyclohexan und seine Konformationsisomerie genau ansiehst. Das IMPP fragt besonders gerne nach den Unterschieden zwischen axialen und äquatorialen Positionen von Substituenten und welchen Einfluss diese auf die Stabilität der Konformation haben.
Substituentenpositionierung und -inversion
Substituenten am Cyclohexan nehmen entweder eine axiale oder eine äquatoriale Position ein. Äquatoriale Positionen sind generell energetisch bevorzugt, insbesondere für größere Substituenten, da sie weniger sterische Spannung verursachen als axiale Positionen. Eine Ringinversion, bei der sich die Sesselkonformation “umklappt”, kann zu einer Umverteilung der Substituenten zwischen axialen und äquatorialen Positionen führen.
Das IMPP interessiert sich oft für die energetische Stabilität der verschieden Substituentenpositionen im Cyclohexan und für die Ringinversion, die zu einer Umverteilung der Substituenten führt. Es ist wichtig zu verstehen, dass äquatoriale Positionen meistens energetisch günstiger sind als axiale.
Zusammenfassung
Feedback
Melde uns Fehler und Verbesserungsvorschläge zur aktuellen Seite über dieses Formular. Vielen Dank ❤️
Footnotes
Credits Konformationsisomere Grafik: Tomas Kindahl, Staggered, als gemeinfrei gekennzeichnet, Details auf Wikimedia Commons↩︎
Credits Newman-Projektion Grafik: Jü, N-Butane (Newman) V.2, CC0 1.0↩︎
Credits Energetische Unterschiede der Konformationen von Cyclohexan Grafik: Autor unbekannt.↩︎
