Säure-Base-Stärke
IMPP-Score: 1.6
Säure- und Basenstärke: pKa und pKb Werte
Bei der Vorbereitung auf das Thema “Säure- und Basenstärke” geht es um die Verständnis der Konzepte pKa und pKb. Diese Werte sind essenziell, um die Stärke von Säuren und Basen beurteilen und das Verhalten ihrer Salze in wässrigen Lösungen vorhersagen zu können.
Was ist pKa und pKb?
Der pKa-Wert ist der negative logarithmus (Basis 10) der Säurekonstante Ka:
\[ pKa = -\log(Ka) \]
Analog dazu ist der pKb-Wert der negative Logarithmus der Basenkonstante Kb:
\[ pKb = -\log(Kb) \]
Diese Werte geben Aufschluss über die Tendenz einer Säure, ein Proton abzugeben (pKa), oder einer Base, ein Proton aufzunehmen (pKb).
Die Bedeutung von pKa und pKb für Säuren und Basen
Je niedriger der pKa-Wert einer Säure, desto stärker ist sie. Diese Säuren neigen dazu, in wässriger Lösung vollständig zu dissoziieren. Für Basen gilt: Je niedriger der pKb-Wert, desto stärker die Base.
Dissoziation von Säuren und Basen
Eine starke Säure dissoziiert in wässriger Lösung vollständig und gibt ein Proton ab:
\[ HA + H_2O \rightarrow A^- + H_3O^+ \]
Bei einer schwachen Säure ist die Dissoziation unvollständig:
\[ HA + H_2O \rightleftharpoons A^- + H_3O^+ \]
Die Dissoziation einer Base funktioniert analog, nur dass hier ein Proton aufgenommen wird.
Salze schwacher Säuren und Basen
Das Verhalten von Salzen in Lösung kann man auf Basis der pKa- und pKb-Werte der entsprechenden Säure-Base-Paare erklären. Ein Salz, das aus einer schwachen Säure und einer starken Base besteht, wird in einer wässrigen Lösung typischerweise eine alkalische Reaktion zeigen.
Für das IMPP ist das Verständnis des Zusammenhangs zwischen den pKa- und pKb-Werten und dem pH-Wert einer Lösung besonders wichtig. Beachte, dass stärkere Säuren und Basen zu extremen pH-Werten führen können.
Konjugierte Säure-Base-Paare und die Beziehung zwischen pKa und pKb
In wässriger Lösung bildet jede Säure mit ihrer konjugierten Base und umgekehrt jede Base mit ihrer konjugierten Säure ein Paar. Der Zusammenhang zwischen pKa und pKb ist durch die Formel
\[ pKb = 14 - pKa \]
bei 25°C gegeben. Das bedeutet, dass die Addition des pKa-Wertes einer Säure und des pKb-Wertes ihrer konjugierten Base immer 14 ergibt.
pKa, pKb und der pH-Wert
Der pKa- und pKb-Wert spielen eine wesentliche Rolle bei der Berechnung des pH-Wertes von Säure- oder Basenlösungen. Für die einfache Berechnung des pH-Wertes einer schwachen Säure wird die Henderson-Hasselbalch-Gleichung verwendet:
\[ pH = pKa + \log \left( \frac{[A^-]}{[HA]} \right) \]
Hierbei ist \([A^-]\) die Konzentration der deprotonierten Form (Base) und \([HA]\) ist die Konzentration der protonierten Form (Säure).
Für Basen verwendet man oft die vereinfachte Formel:
\[ pH = 14 - 1/2 pKb + 1/2 \log(Cb) \]
wobei \(Cb\) die Konzentration der Base ist.
Faktoren, die pKa und pKb beeinflussen
Säure- und Basenstärke, und damit auch pKa und pKb, werden durch strukturelle Faktoren wie Elektronegativität und Mesomeriestabilisierung beeinflusst. Beispielsweise erhöhen Substituenten, die Elektronen abziehen können, die Säurestärke, indem sie die Abspaltung des Protons erleichtern.
Die Acidität kann ebenfalls durch den induktiven Effekt beeinflusst werden, wie bei der Trichloressigsäure, die aufgrund der drei Chloratome eine höhere Säurestärke aufweist als die Essigsäure.
Acidität und Basizität: Vergleiche und das Verhalten in Lösungen
Grundlagen der Säure-Base-Stärke
Zunächst ist es wichtig, sich klarzumachen, dass die Stärke von Säuren und Basen entscheidend ist, um ihr Verhalten in Lösungen zu verstehen. Starke Säuren und Basen dissoziieren in wässriger Lösung vollständig, das bedeutet, dass sie alle ihre Protone (im Falle von Säuren) oder Hydroxid-Ionen (im Falle von Basen) an das Lösungsmittel Wasser abgeben. Salze starker Säuren und Basen führen somit zu neutralen Lösungen.
Die vollständige Dissoziation starker Säuren und Basen führt zu neutralen Lösungen von Salzen dieser Säuren und Basen in Wasser.
Im Gegensatz dazu dissoziieren schwache Säuren und Basen nur teilweise, was dazu führt, dass das Gleichgewicht zwischen der nicht dissoziierten Form und den Ionen (Protonen oder Hydroxid-Ionen) in der Lösung besteht. Dies beeinflusst maßgeblich den pH-Wert der Lösung, wenn diese Salze gelöst werden.
pKa- und pKb-Werte
Der pKa-Wert ist ein Maß für die Stärke einer Säure, wobei kleinere pKa-Werte auf eine stärkere Säure hinweisen. Umgekehrt deutet ein großer pKa-Wert auf eine schwache Säure hin. Der pKb-Wert funktioniert analog für Basen.
Das IMPP fragt besonders gerne nach den Zusammenhängen zwischen pKa-/pKb-Werten und dem pH-Wert der Lösungen. Es ist also besonders wichtig, dass ihr den pKa- und pKb-Wert mit der Acidität bzw. Basizität in Verbindung setzen könnt.
Das Verhalten von Salzen in wässriger Lösung
Wie reagiert ein Salz in wässriger Lösung? Die Antwort hängt von der relativen Stärke der Säure und der Base ab, aus denen das Salz besteht. Ein Salz einer starken Säure und einer schwachen Base tendiert dazu, eine saure Lösung zu bilden, da die konjugierte Base der starken Säure eine geringe Tendenz hat, Protonen aufzunehmen. Umgekehrt führt ein Salz aus einer schwachen Säure und einer starken Base meist zu einer alkalischen Lösung.
Ampholyte und ihre Rolle
Ampholyte wie das Bicarbonat-Ion (\(\text{HCO}_3^-\)) können je nach Bedingungen sowohl als Säure als auch als Base fungieren. Das bedeutet, dass sie sowohl Protonen aufnehmen als auch abgeben können. Welche Funktion sie in der Lösung einnehmen, hängt von den pKa- und pKb-Werten sowie von den vorliegenden Konzentrationen der anderen Ionen in der Lösung ab.
Relevanz des induktiven Effekts
Ein weiterer wichtiger Punkt ist der induktive Effekt. Säuren wie Trichloressigsäure sind stärker als Essigsäure, da die Chloratome über den induktiven Effekt die Abgabe von Protonen erleichtern. Ebenso wird die Stärke von Säuren und deren Salzen durch den Einfluss von Elektronegativitäten und der Fähigkeit von Atomen zur Stabilisierung von Ladungen, beispielsweise über Mesomerie, bestimmt.
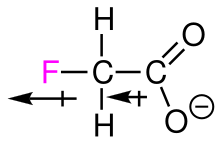
Als Beispiel wie sich der induktive Effekt auf den pKs / pKa-wert auswirkt, können wir die folgende Grafik nutzen:
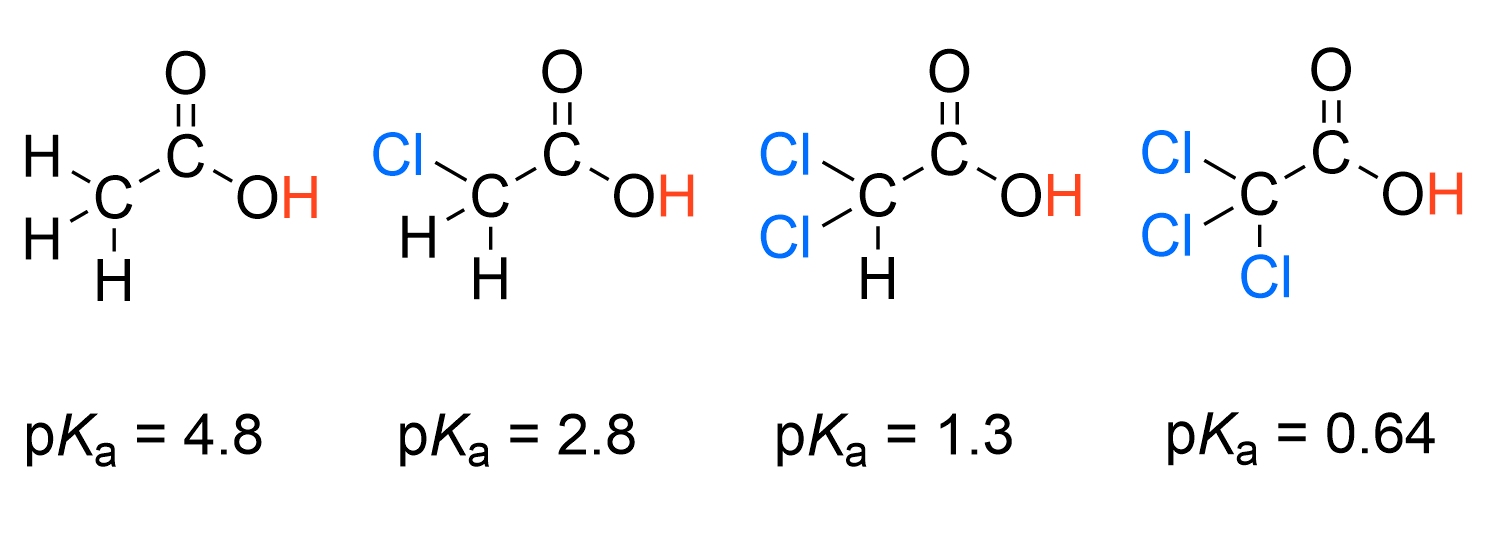
Je mehr induktive Effekte wir über die Chloratome haben, desto stärker ist die Säure und desto kleiner der pKa Wert.
Das IMPP prüft häufig das Verständnis für den induktiven Effekt und Mesomerie, weil diese Konzepte essentiell sind, um das Verhalten von Säuren und Basen in organischen Molekülen zu erklären.
Zusammenfassung
Feedback
Melde uns Fehler und Verbesserungsvorschläge zur aktuellen Seite über dieses Formular. Vielen Dank ❤️
Footnotes
Credits Beispiel eines induktiven Effekts Grafik: Moya.priroda, Fluoroacetate Anion, CC BY-SA 4.0↩︎
Credits Auswirkungen des induktiven Effekts auf Säurestärke. Grafik: KingisNitro, Chloroacetic pka, CC BY-SA 4.0↩︎