1. Hauptsatz der Thermodynamik
IMPP-Score: 1.1
1. Hauptsatz der Thermodynamik und seine Anwendung in chemischen Reaktionen
Der 1. Hauptsatz der Thermodynamik ist als Energieerhaltungssatz bekannt und ist grundlegend für das Verständnis von Energieflüssen und -umwandlungen in chemischen Reaktionen. In seiner Essenz besagt dieser Satz, dass Energie nicht geschaffen oder zerstört, sondern nur von einer Form in eine andere umgewandelt oder von einem System zu einem anderen übertragen werden kann.
Energieerhaltung in chemischen Systemen
In einem isolierten System - einem System, das weder Energie noch Materie mit der Umgebung austauschen kann - bleibt die Gesamtenergie konstant. Bei chemischen Reaktionen in einem geschlossenen System, das Energie austauschen, aber keine Materie abgeben oder aufnehmen kann, muss jede Änderung der inneren Energie durch gleichzeitige Änderungen in Form von Wärme und Arbeit erklärt werden.
Thermodynamische Zustandsgrößen: Enthalpie
Die Enthalpie \(H\) ist eine thermodynamische Zustandsgröße, die die Energie eines Systems umfasst, einschließlich der Energie, die notwendig ist, um das System unter konstantem Druck auf sein Volumen zu bringen. Die Änderung der Enthalpie \(\Delta H\) gibt an, wie viel Energie während einer chemischen Reaktion in Form von Wärme ausgetauscht wird.
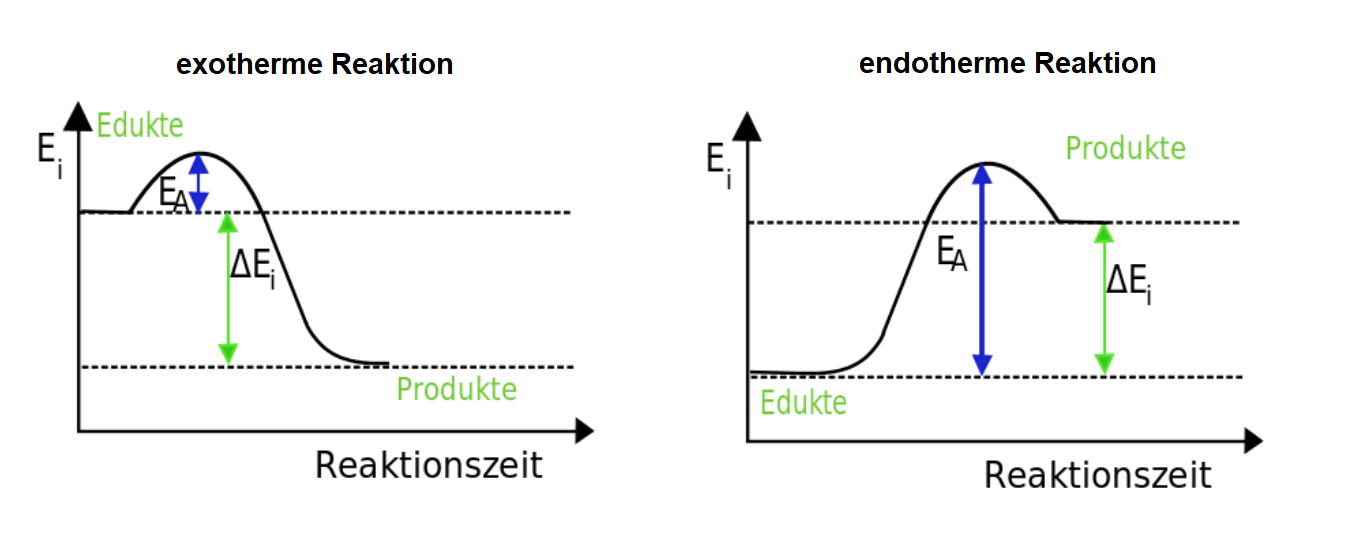
Für das IMPP ist die Richtung der Enthalpieänderung besonders wichtig. Erinnert euch, dass ein negatives \(\Delta H\) eine exotherme Reaktion beschreibt, bei der Energie abgegeben wird, und ein positives \(\Delta H\) eine endotherme Reaktion, bei der Energie aufgenommen wird.
Endotherme vs. Exotherme Reaktionen
Reaktionen lassen sich in zwei Haupttypen einteilen:
- Exotherme Reaktionen: Geben Energie in Form von Wärme ab (\(\Delta H < 0\)). Ein alltägliches Beispiel ist die Verbrennung von Kraftstoffen. Diese sind besonders relevant, da sie häufig in der Natur und Industrie vorkommen.
- Endotherme Reaktionen: Nehmen Energie auf (\(\Delta H > 0\)).
Die energetischen Unterschiede der beiden Reaktionsarten sind auch noch einmal in der folgenden Grafik dargestellt:
Hess’scher Satz in der Praxis
Der Hess’sche Satz spielt eine entscheidende Rolle bei der Berechnung von Reaktionsenthalpien. Er offenbart, dass \(\Delta H\) nur vom Anfangs- und Endzustand eines Systems abhängig ist, nicht jedoch vom Reaktionsweg. Somit können die Enthalpien von Teilreaktionen addiert werden, um die Gesamtreaktionsenthalpie zu erhalten.
Das grundsätzliche Konzept von dem Hess’schen Satz ist in der Grafik dargestellt.
Berechnung von Reaktionsenthalpien
Das IMPP fragt oft nach der Berechnung von Reaktionsenthalpien durch die Standardbildungsenthalpien. Ihr müsst verstehen, wie man die Enthalpien aller Reaktanten und Produkte berücksichtigt, um die gesamte Energieänderung einer Reaktion zu ermitteln.
Beispiele für Standardenthalpie und Verbrennungsenthalpien
Die Standardbildungsenthalpie \(\Delta H^\circ_f\) bezieht sich auf die Energie, die bei der Bildung einer Verbindung aus deren Elementen bei Standardbedingungen (25 °C und 1013 mbar) aufgenommen oder freigesetzt wird. Verbrennungsenthalpien sind ein Spezialfall, bei dem es sich um die Energie handelt, die bei der Verbrennung einer Substanz freigesetzt wird, und sie entsprechen der negativen Bildungsenthalpie.
Messmethoden für Enthalpieänderungen: Kalorimeter
Zur experimentellen Bestimmung von Enthalpien kommt oft ein Kalorimeter zum Einsatz. Dieses Gerät misst die Wärme, die von einer Reaktion abgegeben oder aufgenommen wird.
Anwendungen des ersten Hauptsatzes
- Born-Haber-Kreisprozess: Ein klassisches Beispiel, das die Anwendung des Energieerhaltungssatzes darstellt, um die Gitterenergien von Kristallen zu berechnen.
- Schmelz- und Verdampfungswärme: Diese Größen illustrieren, wie Energie ohne Temperaturänderung einem System zugeführt werden kann, dabei wird die innere Energie gemäß dem ersten Hauptsatz verändert.
Vergleiche immer die Energie der Produkte und Edukte miteinander, um die Richtung und den Betrag der Energieänderung zu bestimmen. Dies ist wichtig, um vorherzusagen, ob eine Reaktion exotherm oder endotherm verläuft.
Praktische Bedeutung exothermer Reaktionen
Exotherme Reaktionen sind besonders relevant, da sie in vielen alltäglichen Situationen wie der Verbrennung von Brennstoffen auftreten und so eine unmittelbare Auswirkung auf unsere Umwelt und Technologie haben.
Beim Examen solltet ihr euch insbesondere auf die Anwendung des Hess’schen Satzes, die Unterscheidung zwischen exothermen und endothermen Reaktionen und die Berechnung von Reaktionsenthalpien mit der Standardbildungsenthalpie konzentrieren.
Abschließend: Vergesst nicht, dass die Thermodynamik und der 1. Hauptsatz der Thermodynamik zentrale Konzepte in der Chemie sind, die euch helfen, die Energieumwandlungen in Reaktionen zu verstehen und vorherzusagen.
Zusammenfassung
Feedback
Melde uns Fehler und Verbesserungsvorschläge zur aktuellen Seite über dieses Formular. Vielen Dank ❤️
Footnotes
Credits Energetische Betrachtung der endo- und exothermen Reaktion Grafik: Sundance Raphael, Movinam, Endothermic reaction (German), als gemeinfrei gekennzeichnet, Details auf Wikimedia Commons↩︎
Credits Satz von Hess Grafik: Johannes Schneider, Hess Waermesatz 30 01 2015, CC BY-SA 4.0↩︎
