Oxide
IMPP-Score: 1.2
Was sind Oxide?
Oxide sind chemische Verbindungen, die aus mindestens einem Sauerstoffatom und einem weiteren Element bestehen. Diese können in unterschiedlichen Strukturen und Oxidationszuständen vorliegen, ebenso wie ihre physikalischen und chemischen Eigenschaften stark variieren.
Schwefeloxide: SO2 und SO3
Schwefel bildet eine Reihe von Oxiden, von denen Schwefeldioxid (SO2) und Schwefeltrioxid (SO3) am bekanntesten sind. SO2 ist ein gewinkeltes Molekül, und SO3 ist planar und fungiert als Anhydrid der Schwefelsäure. Das bedeutet, dass es mit Wasser direkt zu Schwefelsäure (H2SO4) reagiert und nicht zu schwefliger Säure (H2SO3).
Schwefeltrioxid (SO3) spielt eine wichtige industrielle Rolle, da es in Kontakt mit Wasser in H2SO4 umgewandelt wird. Das IMPP fragt besonders gerne nach der Reaktionsgleichung von SO3 mit Wasser, da es ein klassisches Beispiel für die Bildung eines Anhydrids ist.
Oxidationszahlen und Strukturen
Die Oxidationszahl des Sauerstoffs in Oxiden ist üblicherweise -2, jedoch gibt es Ausnahmen, wie in Disauerstoffdifluorid (O2F2), wo Sauerstoff eine Oxidationszahl von +1 hat. Bei der Betrachtung komplexerer Oxide wie Nitrat (NO3-) oder Nitrit (NO2-) spielt die Oxidationszahl des Sauerstoffs eine entscheidende Rolle bei der Bestimmung der Oxidationszahl des zentralen Elements, hier des Stickstoffs.
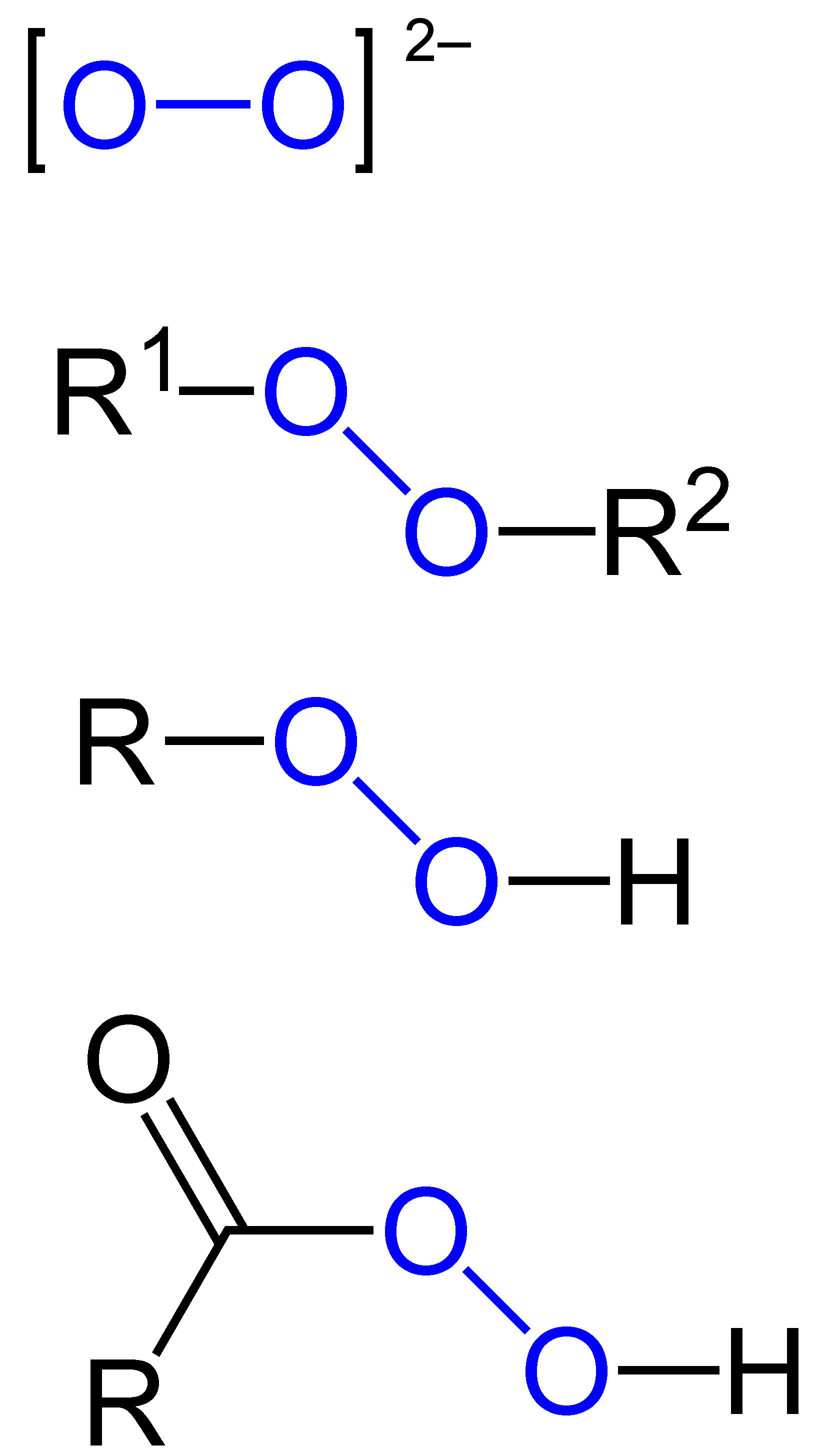
Besondere Oxide: Peroxide und Ozon
Peroxide beinhalten eine -O-O- Bindung, wie es beispielsweise bei Wasserstoffperoxid (H2O2) vorkommt. Bariumperoxid (BaO2) wird in saurer Lösung zu Wasserstoffperoxid hydrolysiert. Ozon (O3) hingegen ist eine allotrope Form von Sauerstoff und besitzt eine gewinkelte Geometrie. Es ist bekannt für seine starke oxidierende Wirkung.
Ozon ist eine besonders interessante Oxid-Verbindung mit einer gewinkelten Struktur und stark oxidierenden Eigenschaften. Für das IMPP ist es wichtig, dass die Winkeleigenschaft und die oxidierende Natur von Ozon verstanden werden.
Amphoterie
Einige Oxide, insbesondere von Metallionen, zeigen amphoterisches Verhalten, was bedeutet, dass sie sowohl mit Säuren als auch mit Basen reagieren können. Dieses Konzept wird am Beispiel von Chrom(VI)-peroxid illustriert, das sowohl Chrom als auch eine Sauerstoff-Sauerstoff-Bindung enthält.
Abgrenzung untypischer “Oxide”
Das IMPP achtet auf die korrekte Klassifikation von Verbindungen. Schwefelhexafluorid (SF6) ist trotz seines Namens kein Oxid, da es keinen Sauerstoff enthält. Es besteht stattdessen aus einem Schwefelatom, das von sechs Fluoratomen umgeben ist.
VSEPR-Theorie zur Molekülgeometrie
Die Valence Shell Electron Pair Repulsion (VSEPR)-Theorie hilft, die geometrische Struktur von Molekülen zu verstehen. Die Anwendung dieser Theorie wird dafür sorgen, dass du die dreidimensionalen Strukturen der Oxid-Moleküle nachvollziehen kannst.
Für das IMPP ist es wichtig, dass ihr die Oxidationszahlen und die Molekülgeometrie von Oxiden versteht. Dies schließt auch ein, zu wissen, wann Sauerstoff positive Oxidationszahlen aufweist, wie bei Disauerstoffdifluorid, und die Struktur und Hybridisierung in Bezug auf VSEPR-Theorie bei SO3.
Zur Vertiefung des Wissens und zur Vorbereitung auf das Examen wird empfohlen, mit den Konzepten zu experimentieren, eigene Strukturmodelle zu zeichnen und die Reaktivität von Oxiden anhand von tatsächlichen Beispielen und Reaktionsgleichungen zu untersuchen.
Zusammenfassung
Feedback
Melde uns Fehler und Verbesserungsvorschläge zur aktuellen Seite über dieses Formular. Vielen Dank ❤️
Footnotes
Credits Struktur der Metalloxide Grafik: Jerónimo Cueto, Estructura de Lewis óxido de magnesio, CC BY-SA 4.0↩︎
Credits Struktur der Peroxide Grafik: Jü, Peroxide group v.2, als gemeinfrei gekennzeichnet, Details auf Wikimedia Commons↩︎
