Sauerstoff
IMPP-Score: 1.6
Allotropie und Struktur des Sauerstoffs
Die Allotropie bei chemischen Elementen ist ein Phänomen, bei dem ein Element in verschiedenen strukturellen Formen vorkommt, die sich in ihren physikalischen und chemischen Eigenschaften unterscheiden. Diese verschiedenen Formen werden Allotrope genannt. Bei dem Element Sauerstoff sind dir vielleicht bereits die zwei bekanntesten Allotrope, O2 und Ozon (O3), ein Begriff.
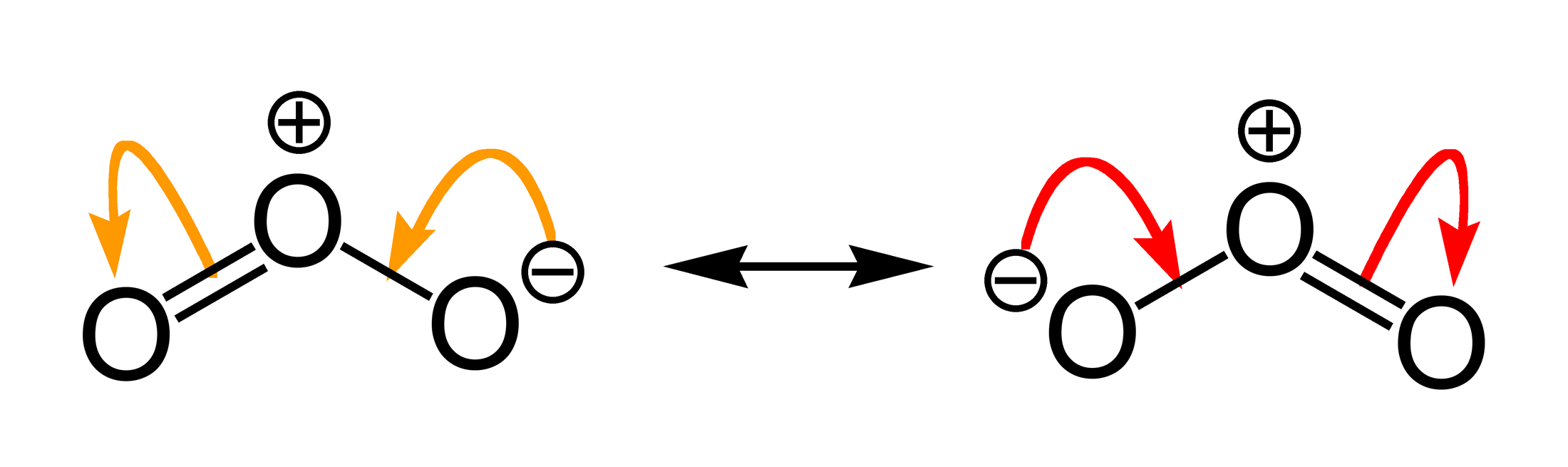
Wir haben euch die mesomeren Grenzstrukturen von Ozon hier einmal aufgezeichnet. Man sollte sie erkennen können.
Weitere Oxidationszustände und Oxidationszahlen
Du hast sicher schon von Wasser (H2O), Sauerstoffdifluorid (OF2) oder sogar Wasserstoffperoxid (H2O2) gehört – dies sind Beispiele für die unterschiedlichen Oxidationszustände von Sauerstoff. In den meisten Verbindungen, wie Wasser, weist Sauerstoff die Oxidationszahl -2 auf, was seiner hohen Elektronegativität und seiner Neigung, Elektronen aufzunehmen, entspricht. Doch Sauerstoff kann auch in seltenen Fällen positive Oxidationszahlen aufweisen, wie du an dem Beispiel OF2 sehen kannst, wo er die Oxidationszahl +2 hat.
Oxidationszustände erinnern
Beim Lernen der Oxidationsstufen solltet ihr immer im Kopf behalten: Sauerstoff weist meistens die Oxidationszahl -2 auf. In Peroxiden wie H2O2 jedoch -1, und in Verbindungen mit Fluor, wie OF2, kann Sauerstoff sogar positive Oxidationszahlen aufweisen.
Besondere Allotrope und seltenere Oxidationszustände
Zum Schluss sollten wir noch besondere Allotrope und die seltenen Oxidationszustände ansprechen. Super- und Hyperoxide, zum Beispiel, zeigen Sauerstoff in der Oxidationszahl -1/2. Diese Verbindungen sind wichtig für fortgeschrittene Konzepte der Anorganischen Chemie, zum Beispiel bei der Untersuchung von Redoxreaktionen in der Biochemie, wo sie als Zwischenprodukte fungieren können.
Es ist zudem nützlich zu wissen, dass Ozon eine gewinkelte Struktur aufweist und als starkes Oxidationsmittel agiert. All diese unterschiedlichen Formen und Zustände des Sauerstoffs zu verstehen, gibt dir die Möglichkeit, die vielfältigen Reaktionen und Anwendungen in der Chemie zu durchschauen.
Reaktivität und Verhalten von Sauerstoff
Sauerstoff ist ein elementares Gas, das zum Leben auf der Erde unerlässlich ist. Es zeigt jedoch eine vielseitige Chemie, die es in der anorganischen Chemie zu verstehen gilt.
Reaktivität und Oxidationsmittel-Eigenschaften
Sauerstoff (O2) ist aufgrund seiner Elektronenkonfiguration ein starkes Oxidationsmittel. Jedes Sauerstoffmolekül besitzt sechs Valenzelektronen, damit insgesamt zwölf für das O2-Dimere. In Reaktionsprozessen neigt Sauerstoff dazu, Elektronen aufzunehmen, wodurch andere Elemente oxidiert werden.
Ein klassisches Beispiel für die Oxidationswirkung von Sauerstoff ist die Bildung von Wasserstoffperoxid (H2O2) durch die Reaktion von Anthrahydrochinon mit Sauerstoff. Durch die Aufnahme von Elektronen vom Anthrahydrochinon wird das Substrat oxidiert und Sauerstoff reduziert, was zur Entstehung von H2O2 führt.
Bei Oxidationsreaktionen nimmt Sauerstoff als Oxidationsmittel Elektronen auf und bewirkt so die Oxidation anderer Substanzen. Dies kann häufig an der Bildung von Oxiden oder Peroxiden wie H2O2 erkannt werden.
Molekulare Struktur und Bindungsverhältnisse
Betrachten wir die molekularen Strukturen wie die von Wasser (H2O). Sauerstoff zeigt eine sp3-Hybridisierung und bildet damit eine Bipyramide mit zwei besetzten und zwei freien Elektronenpaaren, was letzlich zur V-Form des Wasser-Moleküls führt.
Oxidationszahlen des Sauerstoffs
In den meisten Fällen hat Sauerstoff die Oxidationszahl -2, wie in Wasser (H2O) und Alkoholen (beispielsweise Ethanol, C2H5OH). In Wasserstoffperoxid (H2O2) weist er eine Oxidationszahl von -1 auf, was die Peroxid-Bindung kennzeichnet.
In Verbindungen mit Fluor, wie Sauerstoffdifluorid (OF2) und Dioxygenylfluorid (O2F2), zeigt Sauerstoff positive Oxidationszahlen von +2
Zusammenfassung
Feedback
Melde uns Fehler und Verbesserungsvorschläge zur aktuellen Seite über dieses Formular. Vielen Dank ❤️
Footnotes
Credits Mesomere Grenzstrukturen von Ozon Grafik: Benjah-bmm27, Ozone-resonance, als gemeinfrei gekennzeichnet, Details auf Wikimedia Commons↩︎