Brønsted und Lewis
IMPP-Score: 0.8
Säure-Base-Systeme nach Brønsted und Lewis
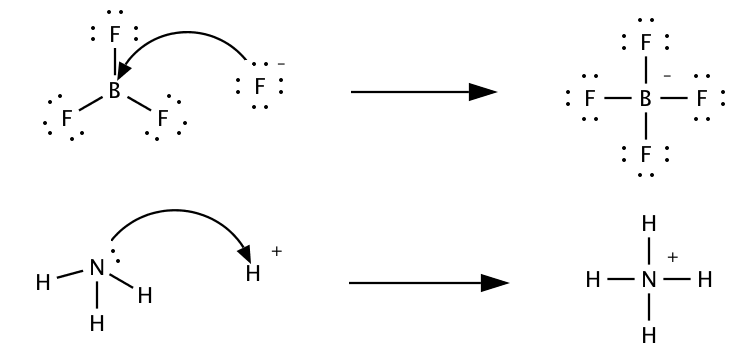
Die beiden verschiedenen Säure-Base-Theorien sind in der folgenden Grafik gezeigt. Oben ist eine typische Lewis-Säure zu sehen, unten eine Brønsted-Säure.
Brønsted-Säuren und -Basen
Zunächst wollen wir uns mit dem Brønsted-Konzept beschäftigen. Laut dem dänischen Chemiker Johannes Nicolaus Brønsted sind Säuren Protonendonatoren und Basen Protonenakzeptoren. Ein gutes Beispiel für eine Brønsted-Säure ist das Ammoniumion (\(NH_4^+\)), das ein Proton abgeben kann, um zu Ammoniak (\(NH_3\)) zu werden. Dem gegenüber steht das Acetation (\(CH_3COO^-\)), ein typisches Beispiel für eine Brønsted-Base, da es ein Proton aus der Umgebung aufnehmen kann.
Beachtet, dass bei einer Säure-Base-Reaktion immer korrespondierende Säure-Base-Paare entstehen. Formiat (\(HCOO^-\)) ist die korrespondierende Base von Ameisensäure (\(HCOOH\)), da es das Proton aufnimmt, das Ameisensäure abgegeben hat.
Ampholyte und Amphoterie
Ein Stoff, der sowohl als Säure als auch als Base agieren kann, nennt man Ampholyt. Ein klassisches Beispiel dafür ist Wasser (\(H_2O\)). Es kann ein Proton aufnehmen und dadurch zu einem Hydroxidion (\(OH^-\)) werden oder ein Proton abgeben, womit es zum Hydroniumion (\(H_3O^+\)) wird.
Autoprotolyse
Die Autoprotolyse ist ein spezieller Fall einer Säure-Base-Reaktion, bei der zwei identische Moleküle unter Übertragung eines Protons miteinander reagieren. Bei Wasser beobachtet man dies, wenn ein Wassermolekül ein Proton an ein anderes Wassermolekül abgibt, wodurch \(OH^-\) und \(H_3O^+\) entstehen.
Lewis-Säuren und -Basen
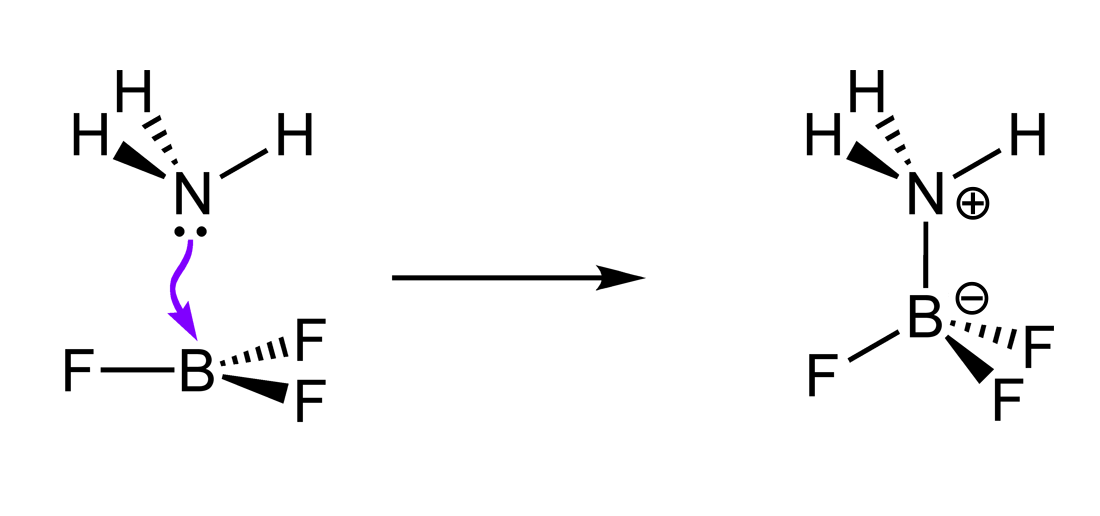
Die Lewis-Theorie erweitert das Brønsted-Konzept um Elektronenpaare. Ein Lewis-Säuren ist ein Elektronenakzeptor und muss dafür eine unvollständig besetzte äußere Elektronenschale haben. Bortrifluorid (\(BF_3\)) ist ein Beispiel dafür, denn es hat Platz für ein zusätzliches Elektronenpaar. Eine Lewis-Base hingegen ist ein Elektronendonator: Sie verfügt über ein freies Elektronenpaar, das sie teilen kann.
pH-Wert
Der pH-Wert ist ein Maß für die Aktivität der Wasserstoffionen in einer Lösung und ist definiert als der negative dekadische Logarithmus der Wasserstoffionen-Aktivität.
Der pH-Wert ist nicht nur ein Zahlenwert, sondern ein zentraler Indikator für das chemische Verhalten von Lösungen. Er wird häufig vom IMPP abgefragt, weshalb ihr genau verstehen solltet, wie ihr ihn bestimmt und interpretiert.
Nicht-Brønsted- oder Lewis-Verhalten
Das IMPP fragt besonders gerne nach Ausnahmefällen und Besonderheiten. Nehmen wir zum Beispiel Natriumhydrid (\(NaH\)), dieses reagiert heftig mit Wasser und bildet dabei keine \(H_3O^+\) oder \(OH^-\) Ionen, weshalb es nicht zu den Brønsted-Säuren oder -Basen gehört. Beim Verständnis dieses Verhaltens müsst ihr genauer auf die Struktur und Reaktion der Substanz achten.
Wichtige Eigenschaften von Atomen und Molekülen
Es ist besonders wichtig, dass ihr die Eigenschaften von Atomen und Molekülen wie Elektronegativität und Bindungsstärke verstanden habt. Diese entscheiden nämlich darüber, ob eine Substanz eher ein Proton abgeben oder aufnehmen wird.
Durch das eingehende Verständnis dieser Konzepte sollt ihr in der Lage sein, die Reaktionen von Säuren und Basen zu analysieren und vorherzusagen. Nutzt die zahlreichen Beispiele, um das theoretische Wissen mit praktischen chemischen Reaktionen zu verbinden und euer Verständnis zu festigen.
Vergleich
Die verschiedenen Säure-Base-Theorien sind konzeptionell in der folgenden Grafik beschrieben.
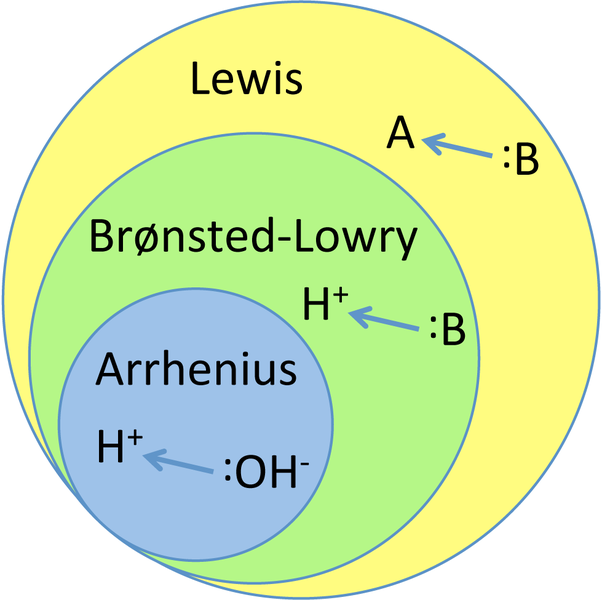
Zusammenfassung
Feedback
Melde uns Fehler und Verbesserungsvorschläge zur aktuellen Seite über dieses Formular. Vielen Dank ❤️
Footnotes
Credits Vergleich von Lewis-Säure (oben) und Brønsted-Säure (unten) Grafik: Myceteae, LewisAcid, als gemeinfrei gekennzeichnet, Details auf Wikimedia Commons↩︎
Credits Lewis-Säure Grafik: Gemeinfrei↩︎
Credits Vergleich der verschiedenen Säure-Base-Theorien Grafik: Tem5psu, Lewis-Bronsted-Arrhenius, CC BY-SA 3.0↩︎