Modelle der chemischen Bindung
IMPP-Score: 1.6
Hybridisierungskonzepte in der organischen Chemie
Die Hybridisierung ist ein zentrales Konzept des Verständnisses molekularer Strukturen in der organischen Chemie. Wenden wir uns zuerst den Grundlagen zu, bevor wir tiefer in die Anwendungsfälle einsteigen.
Definition und Grundlagen der Hybridisierung
Hybridisierung beschreibt den Prozess, bei dem Atomorbitale von vergleichbarer Energie sich kombinieren, um gleichwertige Hybridorbitale zu bilden. Dies geschieht, um die Überlappung zwischen den Orbitalen benachbarter Atome zu maximieren und damit die Bindungsfestigkeit zu erhöhen. Einfach gesagt: Hybridorbitale sind besser für die Bildung von Bindungen geeignet als reine Atomorbitale.
Typen der Hybridisierung und Molekülgeometrie
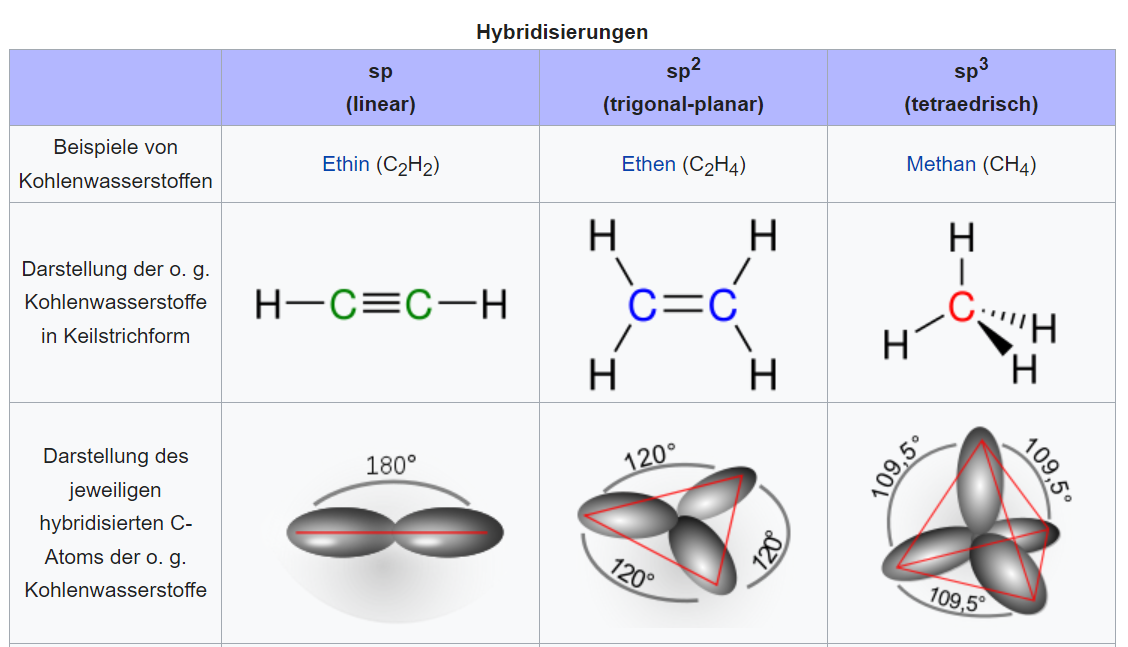
Es gibt mehrere Typen der Hybridisierung: sp, sp2 und sp3. Die Realität dieser Typen hängt von der spezifischen Anzahl und Anordnung der Bindungspartner ab.
sp-Hybridisierung: Diese tritt auf, wenn ein Kohlenstoffatom zwei Bindungspartner hat und zu einer linearen Geometrie führt. Die Hybridisierung kombiniert ein s-Orbital mit einem p-Orbital und resultiert in zwei sp-hybridisierten Orbitalen, die um 180° auseinanderliegen. Beispiele hierfür sind Moleküle wie Acetylen (ethin) und Kohlenmonoxid (CO).
sp2-Hybridisierung: Wenn ein Kohlenstoffatom drei Bindungspartner hat, erfolgt eine sp2-Hybridisierung, was zu einer trigonal-planaren Struktur führt. Die drei sp2-Hybridorbitale sind um 120° zueinander angeordnet. Kohlensäure, 1,3-Butadien und Phenol sind Beispiele für Verbindungen mit sp2-hybridisiertem Kohlenstoff.
sp3-Hybridisierung: Bei vier Bindungspartnern kommt die sp3-Hybridisierung ins Spiel und führt zu einer tetraedrischen Geometrie mit Bindungswinkeln von etwa 109,5°. Methan ist das klassische Beispiel, aber auch Methanol demonstriert diese Hybridisierungsform.
Einen Überblick findet ihr in dieser Tabelle:
Auswirkungen der Hybridisierung auf Elektronegativität und Bindungslängen
Hybridorbitale unterschiedlichen Typs beeinflussen sowohl die Elektronegativität als auch die Bindungslängen. Ein höherer s-Orbitalanteil in einem Hybridorbital – wie bei sp-Hybridisierung – zieht die Bindungselektronen näher zum Kern. Dies erhöht die Elektronegativität und verkürzt die Bindungslänge im Vergleich zu sp2- und sp3-Hybridisierungen. Beispielsweise sind deshalb Bindungen in Alkinen (sp) kürzer und die C-H-Bindungen acidischer als in Alkenen (sp2) oder Alkanen (sp3).
Relevanz der Hybridisierung für Acidität, Aromatizität und mesomere Effekte
Das IMPP fragt besonders gerne nach dem Zusammenhang von Hybridisierung und Acidität. Ein tieferes Verständnis der Hybridisierung ist also essentiell, um die Acidität organischer Verbindungen abschätzen zu können. Hierbei gilt: Je mehr s-Charakter ein Hybridorbital hat (wie bei sp), desto acidischer ist in der Regel die Bindung.
Ähnlich verhält es sich auch bei der Aromatizität. Sp2-hybridisierte Atome in einer planaren Anordnung ermöglichen ein delokalisiertes π-Elektronensystem, was für aromatische Systeme charakteristisch ist. Bei mesomeren Effekten stabilisiert die Möglichkeit, Ladungen über mehrere Atome zu verteilen, beispielsweise Carbeniumionen.
Stabilität von Carbokationen und Ladungsverteilung
Die Stabilität von Carbokationen lässt sich durch das Hybridisierungskonzept verständnisvoll erklären. Carbokationen mit sp2-hybridisierten Atomen sind aufgrund der Möglichkeit zur Delokalisierung der Ladung über das p-Orbital stabilisiert. Dies wirkt sich auch auf die CH-Acidität aus: Ein sp2-hybridisiertes Kohlenstoffatom an einem Carbeniumion macht das Proton leichter abspaltbar.
Visualisierung anhand von Molekülmodellen und Energie-Diagrammen
Um die Konzepte zu veranschaulichen, nutzen wir Molekülmodelle und Energie-Diagramme. Letztere helfen dabei, das Verständnis für energetische Veränderungen während der Bildung und des Bruchs von Bindungen zu schärfen.
Abschließende Überlegungen zur Carbokation-Stabilität
Schließlich ist die Hybridisierung hilfreich, um die Stabilität von Carbokationen aufgrund ihrer Geometrie und Elektronenverteilung zu beurteilen. Sp2-hybridisierte Carbokationen (oft Teil von delokalisierten Systemen) sind generell stabiler als sp-hybridisierte Carbokationen. Dies spiegelt sich in höherer Reaktionsgeschwindigkeit und Energieabsenkung dieser Spezies wider.
Molekülorbital- und Valenzbindungstheorie
Die Molekülorbital- (MO)- und Valenzbindungstheorie (VB) sind zwei zentrale Modelle, die helfen, das Verhalten von Elektronen in Molekülen zu verstehen. Sie bieten Einblicke in Bindungseigenschaften wie Bindungslängen, -winkel und die Gesamtstabilität von Molekülen.
Entstehung von Molekülorbitalen
Bei der Molekülorbitaltheorie gehen wir davon aus, dass sich Atomorbitale überlappen und Molekülorbitale bilden, die sich über das gesamte Molekül erstrecken können. Diese Überlappung kann gerade (sigma-Orbital) oder seitlich (pi-Orbital) sein. Die bindenden Orbitale sind dabei energetisch günstiger als die entsprechenden Atomorbitale und tragen zur Bindungsstabilität bei.
Hier einmal das Beispiel eines \(H_2\) Wasserstoffmoleküls im MO-Schema.
Es gibt bindende und antibindende Orbitale sowie Knotenlinien. Eine Knotenlinie ist eine Fläche im Molekül, an der die Aufenthaltswahrscheinlichkeit der Elektronen null ist. Bindende Orbitale weisen keine oder weniger Knotenlinien auf als antibindende Orbitale.
Energieniveaus und Besetzung im MO-Schema
Im Energiediagramm des Molekülorbitals liegen bindende Orbitale unter und antibindende Orbitale über den Energieniveaus der Atomorbitale. Die Molekülorbitale werden gemäß der Hund’schen Regel besetzt, wonach Orbitale zunächst einfach besetzt werden, bevor Paarung erfolgt.
Valenzbindungstheorie
Die VB-Theorie betrachtet Atome, die durch Überlappung von ihren jeweiligen Atomorbitalen Bindungen eingehen. Dieses Modell betont vor allem Hybridisierungen – eine Mischung von Atomorbitalen eines Atoms zur Erklärung von Molekülgeometrien. Beispielsweise führt eine sp-Hybridisierung zu einer linearen Anordnung von Bindungen.
Unterschiede zwischen MO- und VB-Theorie
Während die VB-Theorie Bindungen als Überlappung von Atomorbitalen erklärt, die lokalisiert sind, beschreibt die MO-Theorie Bindungen als delokalisierte Molekülorbitale, die einem Molekül zugeordnet werden.
Delokalisierung und Aromatizität
Ein klassisches Beispiel für Delokalisierung ist Benzol, ein Aromat mit einem Ring aus sechs Kohlenstoffatomen, in dem die Elektronen über das gesamte Molekül delokalisiert sind. Dies zeigt sich in der MO-Theorie als ein Satz von entarteten (energetisch gleichen) pi-Molekülorbitalen.
Das IMPP fragt besonders gerne nach Aromaten und der Hückel-Regel. Diese besagt, dass planare Ringsysteme mit (4n+2) pi-Elektronen aromatisch sind. Furan und Pyridin sind gute Beispiele, die diese Regel bestätigen und aromatischen Charakter aufweisen.
HOMO und LUMO
Das höchste besetzte Molekülorbital (HOMO) und das niedrigste unbesetzte Molekülorbital (LUMO) sind besonders wichtig für das Verständnis von Reaktivität in organischen Reaktionen, beispielsweise bei [4+2]-Cycloadditionen, welche mit orbitalen Wechselwirkungen beschrieben werden können.
Zusammenfassung
Feedback
Melde uns Fehler und Verbesserungsvorschläge zur aktuellen Seite über dieses Formular. Vielen Dank ❤️
Footnotes
Credits Überblick über die Hybridisierungsformen Grafik: https://de.wikipedia.org/wiki/Hybridorbital↩︎
Credits Molekülorbitaldiagramm für das Wasserstoffmolekül Grafik: Autor unbekannt, Wasserstoff-Orbitale, CC BY-SA 3.0↩︎
Credits HOMO vs LUMO Grafik: Tomgally (creator and/or uploader) Parutakupiu (vectorized version), Molecule HOMO-LUMO diagram, als gemeinfrei gekennzeichnet, Details auf Wikimedia Commons↩︎
