Verbindungen mit zwei oder mehr funktionellen Gruppen
IMPP-Score: 7.8
Allgemeine Betrachtung und Eigenschaften von Verbindungen mit zwei oder mehr funktionellen Gruppen
Organische Verbindungen, die zwei oder mehr funktionelle Gruppen besitzen, sind aus mehreren Gründen besonders interessant und wichtig. Zum einen eröffnen sie vielfältige Reaktivitäten und Reaktionsmöglichkeiten. Zum anderen können aufgrund der unterschiedlichen Gruppen ganz spezielle Eigenschaften und Wechselwirkungen auftreten, die in monofunktionalen Verbindungen so nicht zu finden sind.
Beeinflussung der Chemischen Eigenschaften
Die Präsenz mehrerer funktioneller Gruppen in einem Molekül kann die chemischen Eigenschaften maßgeblich beeinflussen:
- Reaktivität: Die Reaktivität eines Moleküls wird oft durch die funktionellen Gruppen bestimmt. Beispielsweise kann eine Carbonylgruppe in unmittelbarer Nähe zu einer anderen funktionellen Gruppe, wie einer Hydroxyl- oder einer Aminogruppe, die Elektrophilie der Carbonylgruppe erhöhen.
- Basizität/Acidität: Die Basizität oder Acidität eines Moleküls kann durch das Vorhandensein mehrerer funktionellen Gruppen dramatisch verändert werden. Beispiele hierfür sind β-Dicarbonylverbindungen, bei denen die Acidität des Wasserstoffs durch die beiden angrenzenden Carbonylgruppen erhöht wird.
- Chelatkomplexbildung: Verbindungen mit zwei oder mehr funktionellen Gruppen, die miteinander koordinieren können, wie etwa Aminosäuren, sind in der Lage, mit Metallionen Chelatkomplexe zu bilden.
Einfluss auf das Reaktionsverhalten
- Chiralität und Isomerie: Die Anordnung der funktionellen Gruppen kann die Chiralität des Moleküls beeinflussen. So kann Cyclohexan-1,2-diol, abhängig von der räumlichen Anordnung der Hydroxylgruppen, chiral oder achiral (meso-Form) sein.
- Sterische Hinderung entsteht oft durch große funktionelle Gruppen, die in räumlicher Nähe zueinander stehen. Dies kann z.B. die Reaktivität bei Esterhydrolysen beeinflussen, indem es den nucleophilen Angriff erschwert.
Beispiele aus Anwendungskontexten
- Polyurethane: Hier zeigt sich die multifunktionelle Eigenschaft von Diolen und Diisocyanaten, die bei der Herstellung dieses wichtigen Kunststoffs reagieren.
- Pharmazeutika: Viele Arzneistoffe haben mehrere funktionelle Gruppen, um an speziellen Stellen im Körper gezielt zu wirken.
- Naturstoffe: Komplexe Naturstoffe wie Vitamine oder Antibiotika enthalten oft ein Vielzahl an funktionellen Gruppen, wodurch sie ihre biologische Aktivität entfalten können.
Das IMPP fragt besonders gerne nach der Reaktivität und den Syntheserouten, die mit Verbindungen mit zwei oder mehr funktionellen Gruppen in Verbindung stehen. Hier ist es besonders wichtig, dass ihr die Auswirkungen der funktionellen Gruppen auf die Gesamtmolekülstruktur und deren Reaktionsverhalten versteht. Beispielsweise könntet ihr gefragt werden, wie sich die Nähe von zwei Carbonylgruppen auf die Stabilität eines Enolats auswirkt oder wie sich funktionelle Gruppen auf die Basizität oder Acidität einer Verbindung auswirken.
Reaktionen und Synthesewege mit Verbindungen mit zwei oder mehr funktionellen Gruppen
Verbindungen mit zwei oder mehr funktionellen Gruppen präsentieren eine reiche Chemie. Insbesondere reagieren sie in einer Vielzahl von Synthesewegen, die die Komplexität und Vielfältigkeit der organischen Chemie deutlich machen. In diesem Abschnitt wirst du lernen, wie diese Verbindungen reagieren und in synthetischen Anwendungen genutzt werden.
Aldol-Kondensationen
Die Aldol-Kondensation ist eine fundamentale Reaktion in der organischen Chemie. Sie involviert die Kondensation von zwei Aldehyden oder Ketonen unter Bildung einer neuen C-C-Bindung. Die Reaktion beginnt mit der Bildung eines Enolats aus einem der Reaktanten, gefolgt von einer nucleophilen Addition an die Carbonylgruppe des anderen Reaktanten. Das darauffolgende Produkt kann dann Wasser abspalten, um ein α,β-ungesättigtes Carbonylderivat zu bilden.
Für das Examen ist es besonders wichtig, dass ihr die einzelnen Schritte der Aldol-Kondensation genau versteht, da das IMPP oft nach den intermediären Strukturen und dem Mechanismus fragt.
Claisen-Kondensationen
In der Claisen-Kondensation reagieren Ester in Gegenwart starker Basen, wie Alkoholate, miteinander und bilden ein β-Ketoester-Produkt. Genau wie bei der Aldol-Kondensation spielt das Enolat-Ion hier eine Schlüsselrolle; es greift die Carbonylgruppe eines anderen Esters an, was zur Bildung einer neuen C-C-Bindung führt.
Knoevenagel-Reaktionen
Die Knoevenagel-Reaktion ähnelt der Aldol-Kondensation, verwendet jedoch ein aktives Methylen, eine Verbindung mit einem pK_a-Wert, der meist niedriger als der von Aldehyden oder Ketonen ist. Diese Reaktion resultiert in der Synthese von Carbon- und Heterocarbon-Verbindungen und ermöglicht die Bildung von Doppelbindungen.
Michael-Additionen
Die Michael-Addition ist eine nucleophile Addition an α,β-ungesättigte Carbonylverbindungen. Bei dieser Reaktion entstehen oft wichtige Zwischenprodukte für weitere Transformationen. Die Steuerung der Selektivität und die Wahl des Nucleophils sind entscheidend.
Mannich-Reaktionen
Die Mannich-Reaktion ist eine Mehrkomponentenreaktion, bei der ein Aldehyd oder Keton, ein Amin (oft Ammoniak oder ein primäres oder sekundäres Amin) und eine CH-acide Verbindung miteinander reagieren. Das Ergebnis ist oft eine Verbindung mit einer Aminoalkylfunktion.

Selektive Reaktivität und Schutzgruppen
Bei Verbindungen mit mehreren funktionellen Gruppen ist selektive Reaktivität entscheidend. Schutzgruppen können verwendet werden, um spezifische funktionelle Gruppen während bestimmter Reaktionsschritte temporär zu deaktivieren. Zum Beispiel werden Ketone und Aldehyde oft als Acetale geschützt, während Alkohole als Silyläther vorübergehend maskiert werden können.
Das Verständnis der Verwendung von Schutzgruppen ist unerlässlich, da diese Techniken die Synthese von komplexen Molekülen erst ermöglichen.
Wichtige Verbindungsklassen mit zwei oder mehr funktionellen Gruppen
In diesem Abschnitt widmen wir uns der spannenden Welt der organischen Verbindungen, die mit mindestens zwei funktionellen Gruppen ausgestattet sind. Diese Verbindungsklassen bieten durch ihre vielseitigen Reaktionsmöglichkeiten faszinierende Einblicke in die Chemie und ermöglichen eine Brücke zur Synthese komplexer Moleküle.
α-Hydroxycarbonsäuren
Beginnen wir mit den α-Hydroxycarbonsäuren. Diese Verbindungen zeichnen sich durch das Vorhandensein einer Carboxygruppe und einer Hydroxygruppe am benachbarten C-Atom aus. Die bekannteste ist wohl die Milchsäure, die uns unter anderem im Stoffwechsel begegnet. Die Acidität solcher α-Wasserstoffatome erlaubt es, leicht Enolate zu bilden, was in Synthesewegen eine Schlüsselrolle spielt.
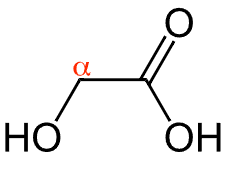
Ein häufig geprüfter Aspekt ist die Acidität der α-Wasserstoffatome:
Acidität von α-Hydroxycarbonsäuren
Besonders wichtig ist es, die gesteigerte Acidität der α-Wasserstoffatome zu verstehen. Das IMPP fragt gerne danach, wie sich die Nähe der funktionellen Gruppen darauf auswirkt.
α,β-ungesättigte Carbonylverbindungen
α,β-ungesättigte Carbonylverbindungen verfügen über eine Doppelbindung in Konjugation zu einer Carbonylgruppe. Dies ermöglicht Reaktionen wie die Michael-Addition oder die Aldol-Kondensation. In der Praxis sind sie als elektrophile Partner in der Michael-Reaktion beliebt:
Elektrophile Eigenschaften von α,β-ungesättigten Verbindungen
Das IMPP legt Wert darauf, dass du die Fähigkeit besitzt, das elektrophile Zentrum dieser Verbindungen zu identifizieren.
β-Dicarbonylverbindungen
Bei β-Dicarbonylverbindungen beeinflussen sich die beiden Carbonylgruppen gegenseitig und steigern die Acidität der dazwischenliegenden α-Wasserstoffatome. Diese Verbindungen sind daher besonders reaktiv in Bezug auf die Enolatbildung und spielen in vielen Synthesen eine zentrale Rolle:
Stabilisierung durch Enolatbildung
Wichtig ist die Stabilisierung der Enolate durch Delokalisation der negativen Ladung. Diese Eigenschaft macht β-Dicarbonylverbindungen für das IMPP examensrelevant.
Diole
Die Gruppe der Diole, mit zwei Hydroxygruppen in ihrem Molekül, zeigt interessante Eigenschaften. Beispielsweise können meso-Diole, deren Struktur eine Symmetrieebene aufweist, optisch inaktiv sein, trotz der Anwesenheit mehrerer chiraler Zentren:
Meso-Verbindungen und optische Aktivität
Meso-Verbindungen wie meso-Cyclohexan-1,2-diol illustrieren wunderbar die optischen Eigenschaften, die oft Prüfungsthema sind.
Hydrolyse und Schutzgruppen bei mehrfunktionalen Verbindungen
Verbindungen mit zwei oder mehr funktionellen Gruppen bieten in der organischen Synthese eine Vielzahl von Reaktivitäten, da jede funktionelle Gruppe unterschiedlich auf Reagenzien reagieren kann. In diesem Abschnitt betrachten wir speziell die Hydrolyse dieser Verbindungen und den Einsatz von Schutzgruppen, um die Komplexität der Synthese zu kontrollieren.
Hydrolyse von Verbindungen mit zwei oder mehr funktionellen Gruppen
Die Hydrolyse ist eine Reaktion, bei der eine chemische Verbindung durch Reaktion mit Wasser in zwei Produkte gespalten wird. In der organischen Chemie sind Verbindungen wie Ester, Ether und Amide übliche Ziele für Hydrolysereaktionen.
- Esterhydrolyse: Bei der Hydrolyse von Estern reagieren diese mit Wasser, oft unter sauren oder basischen Bedingungen, um die entsprechenden Carbonsäuren und Alkohole zu bilden.
Esterhydrolyse ist eine häufig geprüfte Reaktion. Das IMPP erwartet, dass du sowohl die säure- als auch die basekatalysierte Variante verstehst.
Etherhydrolyse: Ether sind im Vergleich zu Estern und Amiden relativ inert gegenüber Hydrolyse. Es bedarf starker Säuren und hoher Temperaturen, um Ether zu hydrolysieren.
Amidhydrolyse: Amide lassen sich unter sauren oder alkalischen Bedingungen hydrolysieren, um die zugehörigen Carbonsäuren und Amine zu ergeben.
Schutzgruppen in der organischen Synthese
Um die chemische Vielfalt und Reaktivität von Verbindungen mit zwei oder mehr funktionellen Gruppen zu kontrollieren, ist die Verwendung von Schutzgruppen ein wichtiges Konzept.
- Definition von Schutzgruppen: Schutzgruppen sind modifizierende Gruppen, die temporär an eine funktionelle Gruppe angefügt werden, um diese während bestimmter Reaktionsschritte zu schützen und später selektiv entfernt werden können.
Das Verständnis von Schutzgruppen und wann sie eingesetzt werden, ist für komplexe organische Synthesen entscheidend und daher ein prüfungsrelevantes Thema.
- Einsatz von Silyl-Ethern bei Diolen: Um beispielsweise ein Diol gegen Hydrolyse oder andere Reaktionsbedingungen zu schützen, können die Hydroxylgruppen mit Silylchloriden zu Silyl-Ethern umgesetzt werden. Dies verhindert, dass sie reagieren, bis die Schutzgruppe an einem späteren Punkt wieder abgespalten wird - oft unter sauren Bedingungen.
Zusammenfassung
Feedback
Melde uns Fehler und Verbesserungsvorschläge zur aktuellen Seite über dieses Formular. Vielen Dank ❤️
Footnotes
Credits Die Aldolkondensation Grafik: Whoopie23, Aldolkondensation Übersicht-v4, CC BY-SA 3.0↩︎
Credits Die Mannichreaktion Grafik: Jü, Mannich Reaction V.1, als gemeinfrei gekennzeichnet, Details auf Wikimedia Commons↩︎
Credits α-Hydroxycarbonsäuren Grafik: Jü, Hydroxycarboxylic acids Structural Formulae V.1, als gemeinfrei gekennzeichnet, Details auf Wikimedia Commons↩︎
Credits Diole Grafik: Jü, Dioles Structural Formulae V.1, als gemeinfrei gekennzeichnet, Details auf Wikimedia Commons↩︎
Credits Mechanismus der Hydrolyse Grafik: MAtheDA, Verseifung Mechanismus, CC BY-SA 3.0↩︎