Begriffe
IMPP-Score: 4.6
Chiralität und optische Aktivität
Um die Prinzipien der Chiralität und optischen Aktivität in der organischen Chemie zu verstehen, müssen wir zunächst klären, was diese Begriffe bedeuten und wie sie zusammenhängen.
Chiralität in Molekülen
Chiralität, vom griechischen Wort für “Hand” (cheir) abgeleitet, bezieht sich auf eine Eigenschaft von Objekten, die nicht mit ihrem Spiegelbild deckungsgleich sind – so wie unsere Hände. In der Chemie sprechen wir von chiralen Molekülen, wenn wir Moleküle meinen, die sich wie Bild und Spiegelbild verhalten, aber nicht zur Deckung gebracht werden können.
Das klassische Beispiel für ein chirales Molekül ist ein Kohlenstoffatom, das mit vier verschiedenen Substituenten verbunden ist, bekannt als ein Chiralitätszentrum oder Stereozentrum:
- Chiralitätszentrum: Jedem der vier Substituenten kann eine unterschiedliche Priorität zugewiesen werden, basierend auf ihrer atomaren Nummer. Die räumliche Anordnung dieser Substituenten um das Zentrum herum definiert die Konfiguration des Moleküls. Zwei chirale Moleküle, die sich wie Bild und Spiegelbild verhalten, werden als Enantiomere bezeichnet.
Enantiomere haben die gleichen physikalischen Eigenschaften, wie Schmelzpunkt und Siedepunkt, zeigen aber unterschiedliche optische Aktivitäten und reagieren unterschiedlich in einer chiral wirkenden Umgebung, wie bei biologischen Systemen.
Optische Aktivität und Polarisiertes Licht
Optische Aktivität ist die Fähigkeit eines chiralen Moleküls, die Ebene des polarisierten Lichts zu drehen. Dies wird normalerweise in einem Polarimeter gemessen, wo das Ausmaß der Drehung der Ebene des Lichts quantifiziert wird.
- Enantiomere: Sie drehen die Polarisationsebene des Lichts um den gleichen Betrag, aber in entgegengesetzte Richtungen. Das Molekül, das das Licht nach rechts dreht, wird als (R)-Enantiomer bezeichnet, während das entsprechende Spiegelbild, das das Licht nach links dreht, als (S)-Enantiomer bekannt ist.
Das IMPP fragt besonders gerne nach der Beziehung zwischen der Struktur von Enantiomeren und ihren Auswirkungen auf polarisiertes Licht sowie den Konsequenzen ihrer optischen Aktivität in biologischen Systemen.
Molekülexempel und ihre Chiralität
Enantiomere Moleküle
Nehmen wir als Beispiel ein einfaches Molekül wie 2-Butanol. Es hat die Summenformel C₄H₁₀O und enthält ein Chiralitätszentrum am zweiten Kohlenstoffatom. Die vier verschiedenen Substituenten (eine Hydroxylgruppe, eine Methylgruppe, eine Ethylgruppe und ein Wasserstoffatom) bewirken, dass es zwei verschiedene Enantiomere gibt, die nicht superponierbar sind.
Moleküle ohne Chiralität
Nicht alle Moleküle mit mehreren Chiralitätszentren sind zwangsläufig chiral. Ein klassisches Beispiel dafür ist Mesoweinsäure, die zwei Chiralitätszentren enthält, aber aufgrund einer Symmetrieebene im Molekül achiral ist.
Meso-Verbindungen
Eine Meso-Verbindung ist ein diastereomeres Molekül, das mindestens zwei Chiralitätszentren enthält, aber aufgrund interner Symmetrie achiral und optisch inaktiv ist. Dies bedeutet, dass die Molekülhälften sich im Molekül selbst spiegeln.
E/Z-Isomerie
Die E/Z-Isomerie ist eine besondere Form der Stereoisomerie bei Alkenen. Hier bestimmt die räumliche Anordnung der Prioritäten um die C=C-Doppelbindung, welches Isomer vorliegt. Wenn die höher priorisierten Gruppen auf gegenüberliegenden Seiten (entgegengesetzt) sind, spricht man von einem E-Isomer (German ‘Entgegen’). Liegen sie auf derselben Seite (zusammen) des Moleküls, bezeichnet man es als Z-Isomer (German ‘Zusammen’).
Es ist wichtig, die Cahn-Ingold-Prelog-Prioritätsregeln zu verstehen, um E/Z-Isomere korrekt identifizieren und benennen zu können.
Enantiomere und Diastereomere
Zwei Stereoisomere eines Moleküls, die sich wie Bild und Spiegelbild verhalten und nicht zur Deckung gebracht werden können, nennt man Enantiomere. Hierbei ist das IMPP besonders daran interessiert, ob du die Fähigkeit besitzt, das Vorhandensein von Chiralitätszentren zu erkennen und die daraus resultierenden Enantiomeren zu differenzieren.
Diastereomere hingegen sind Stereoisomere, die nicht spiegelbildlich zueinander sind. Dies tritt ein, wenn ein Molekül zwei oder mehr Chiralitätszentren besitzt, sich aber nicht an allen diesen Zentren umgekehrt verhält.
Projektionsmethoden und Darstellung von Stereoformeln – Verständnis von Fischer-, Newman- und Sesselformeln
Stereochemie ist ein zentraler Bereich der Organischen Chemie, und ein gutes Verständnis der verschiedenen Projektionsmethoden und Darstellungen von Stereoformeln ist essenziell. In diesem Abschnitt werden wir uns speziell auf die Fischer-, Newman- und Sesselformeln konzentrieren.
Fischer-Projektionen
Die Fischer-Projektion ist eine zweidimensionale Darstellungsform für Moleküle, die vor allem für Kohlenhydrate und Aminosäuren genutzt wird. In einer Fischer-Projektion steht das Molekül vertikal mit dem am höchsten oxidierten Kohlenstoff (oft ein Carbonylkohlenstoff bei Zuckern) an der Spitze.
- Die horizontale Linie repräsentiert Bindungen, die nach vorne zeigen (aus der Papierebene heraus zum Betrachter).
- Die vertikale Linie repräsentiert Bindungen, die nach hinten zeigen (in die Papierebene hinein vom Betrachter weg).
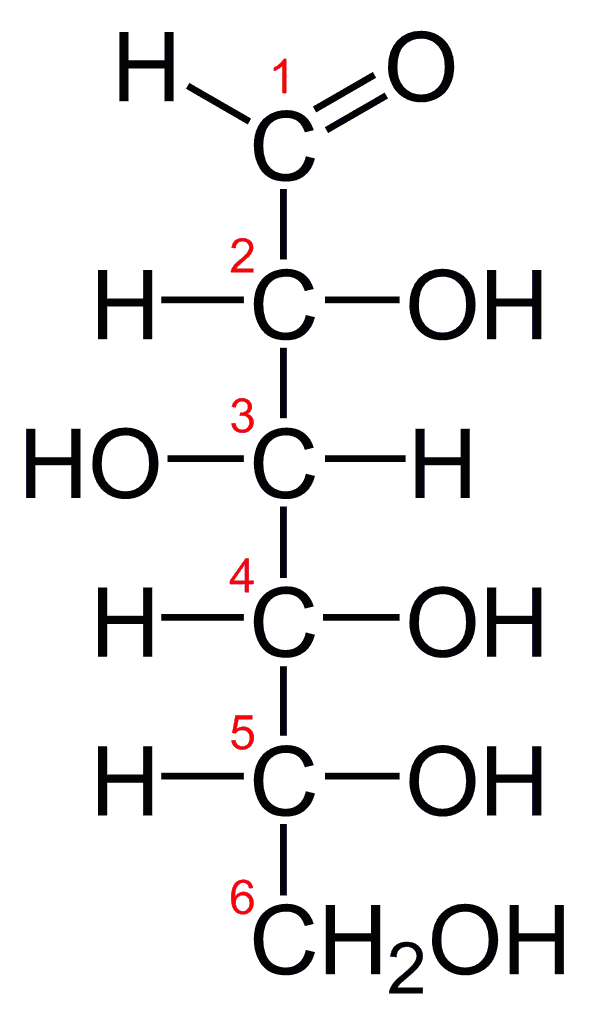
Chirale Zentren werden in der Fischer-Projektion durch ihre räumliche Anordnung repräsentiert, wobei Substituenten rechts oder links vom Zentrum gezeichnet werden. ‘D-’ und ‘L-’ bezeichnen dabei die absolute Konfiguration basierend auf der historischen Anordnung der Aminogruppen in der Fischer-Projektion von Glyceraldehyd, wobei ‘L’ für die Aminogruppe links und ‘D’ für die Aminogruppe rechts steht.
Das IMPP fragt besonders gerne nach der Interpretation von Fischer-Projektionen, da diese grundlegend für das Verständnis der Chiralität und der biochemischen Moleküle sind.
Zusammenfassung
Feedback
Melde uns Fehler und Verbesserungsvorschläge zur aktuellen Seite über dieses Formular. Vielen Dank ❤️
Footnotes
Credits Überblick über die Begrifflichkeiten Grafik: Isomerism-ball.svg: GYassineMrabetTalk✉ This W3C-unspecified vector image was created with Inkscape . Isomerism-ball-de.svg: *Isomerism-ball.svg: YassineMrabet. derivative work: Matt (talk) derivative work: Roland.chem (talk), Isomerism-ball-V2.de, CC BY-SA 3.0↩︎
Credits Konzept der Chiralität Grafik: Original: Unknown Vector: – πϵρήλιο, Chirality with hands, als gemeinfrei gekennzeichnet, Details auf Wikimedia Commons↩︎
Credits 2-Butanol Grafik: Emeldir, Butan-2-ol 200, als gemeinfrei gekennzeichnet, Details auf Wikimedia Commons↩︎
Credits Meso-Weinsäure mit Chiralitätszentren und Symmetrieebene Grafik: NEUROtiker, Meso-Weinsäure Spiegel, als gemeinfrei gekennzeichnet, Details auf Wikimedia Commons↩︎
Credits Fisherprojektion von Glucose Grafik: Ben; Yikrazuul, D-glucose-chain-2D-Fischer, als gemeinfrei gekennzeichnet, Details auf Wikimedia Commons↩︎
