Elektrolytloesungen
IMPP-Score: 0.4
Elektrolytlösungen
Dissoziation von Elektrolyten in Wasser
Wenn Elektrolyte in Wasser gelöst werden, zerfallen sie in positiv und negativ geladene Ionen. Diese Dissoziation ist ein kritischer Prozess, da er die Eigenschaften der Lösung stark beeinflusst. Starke Elektrolyte, wie Kaliumhexacyanidoferrat(III), dissoziieren vollständig, was bedeutet, dass jede einzelne Einheit des gelösten Stoffs in Ionen zerfällt. Dies hat wichtige Konsequenzen, beispielsweise für die Gefrierpunktserniedrigung: Mehr gelöste Teilchen führen zu einer stärkeren Herabsetzung des Gefrierpunkts als erwartet.
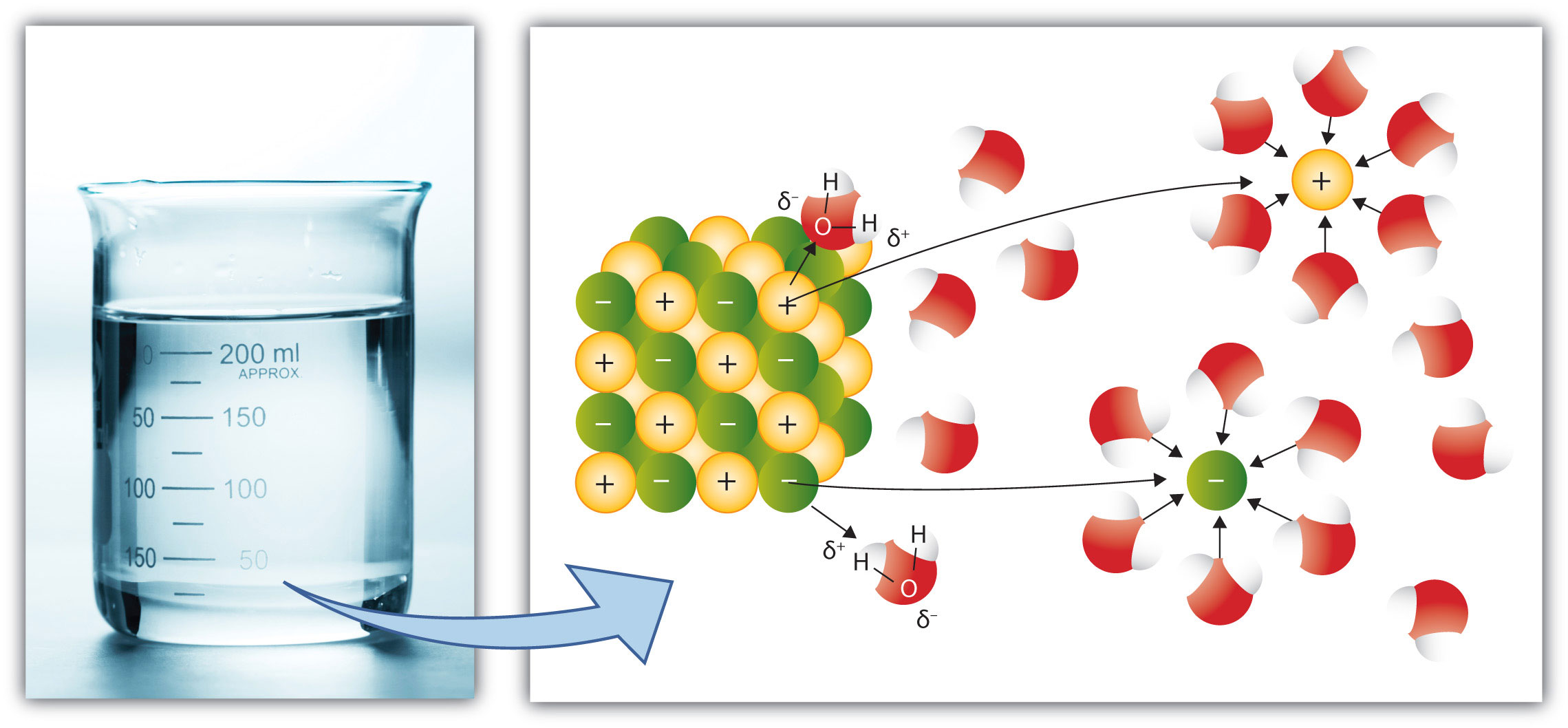
Starke, schwache und mehrstufige Elektrolyte
Starke Elektrolyte dissoziieren vollständig in Wasser, wobei keine ungeladenen Moleküle zurückbleiben. Zu diesen zählen Salze, starke Säuren und Basen. Im Gegensatz dazu dissoziieren schwache Elektrolyte nur teilweise, was bedeutet, dass im Gleichgewichtszustand sowohl Ionen als auch ungeladene Moleküle existieren.
Das IMPP fragt besonders gerne nach dem Unterschied zwischen starken und schwachen Elektrolyten sowie deren Dissoziationsgrad und -konstanten.
Mehrstufige Elektrolyte, wie die Kohlensäure (H2CO3), dissoziieren in mehreren Schritten, wobei in jedem Schritt unterschiedliche Ionen freigesetzt werden. Der erste Dissoziationsschritt ist in der Regel der stärkste; nachfolgende Schritte sind meist schwächer.
Ostwaldsches Verdünnungsgesetz
Das Ostwaldsche Verdünnungsgesetz gibt Aufschluss über den Dissoziationsgrad eines schwachen Elektrolyten in Abhängigkeit von der Konzentration. Wenn eine schwache Säure oder Base verdünnt wird, steigt der Dissoziationsgrad, und die Konzentration der Ionen erhöht sich relativ zur ursprünglichen Konzentration des Elektrolyten.
pH-Wert und Salze
Der pH-Wert einer Lösung hängt maßgeblich von den in der Lösung vorhandenen Ionen ab. Zum Beispiel führt das Lösungsmittel von Salzen schwacher Basen mit starken Säuren zu einer sauren Lösung, da mehr Hydronium-Ionen (H3O+) gebildet werden. Umgekehrt führen Salze starker Basen mit schwachen Säuren zu einer basichen Lösung, da hier mehr Hydroxid-Ionen (OH-) vorliegen.
Grenzionenleitfähigkeit
Die Grenzionenleitfähigkeit ist ein Maß für die Fähigkeit von Ionen, in sehr verdünnten Lösungen Elektrizität zu leiten, wenn Interaktionen zwischen Ionen vernachlässigbar sind. Insbesondere Hydroxid-Ionen zeigen eine hohe Grenzionenleitfähigkeit aufgrund der besonderen Struktur des Wassers.
Ionenstärke
Die Ionenstärke gibt Auskunft darüber, wie die Konzentration aller Ionen in einer Lösung – unter Berücksichtigung ihrer unterschiedlichen Ladungen – das Verhalten der Lösung beeinflusst. Sie ist entscheidend, um zu verstehen, wie Elektrolytlösungen, z.B. NaCl und KCl, in biologischen oder chemischen Systemen wirken.
Solvatation und Hydratation
Wenn Ionen in Wasser gelöst werden, umhüllen Wassermoleküle die Ionen und bilden eine sogenannte Hydrathülle. Diesen Vorgang bezeichnet man als Hydratation. Die damit verbundene Solvatationsenthalpie ist ein Maß für die Energieänderung während des Lösungsvorgangs.
Wanderung von Ionen unter Elektrolyse
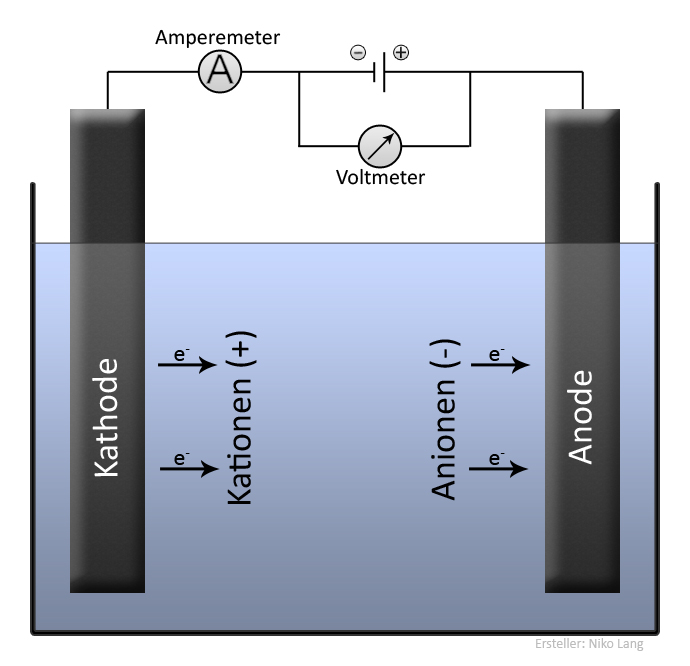
Hier ist es besonders wichtig, dass ihr die Prozesse der Elektrolyse versteht – welche Ionen wohin wandern und welche Reaktionen an den Elektroden stattfinden.
In einem elektrischen Feld wandern Kationen zur Kathode und Anionen zur Anode. Bei der Elektrolyse von Natriumchloridlösung entstehen an der Kathode Wasserstoffgas und an der Anode Chlorgas.
Zusammenfassung
Feedback
Melde uns Fehler und Verbesserungsvorschläge zur aktuellen Seite über dieses Formular. Vielen Dank ❤️
Footnotes
Credits Lösungsvorgang Grafik: Andy Schmitz, Sodium chloride dissolution, CC BY 3.0↩︎
Credits Prinzip der Elektrolyse Grafik: Niko Lang, Elektrolyse Allgemein, CC BY-SA 2.5↩︎
