Fluor, Chlor, Brom und Iod
IMPP-Score: 1.7
Struktur und Eigenschaften der Halogene (Fluor, Chlor, Brom und Iod)
Die Halogene sind die Elemente der Gruppe 17 des Periodensystems und umfassen Fluor, Chlor, Brom und Iod. Ihre Eigenschaften und Strukturen sind faszinierend vielfältig, und um diese im Detail zu verstehen, werden wir einige Schlüsselkonzepte beleuchten.
Farbe und Aggregatzustände bei Normalbedingungen
Bei Normalbedingungen zeigt jedes Halogen eine charakteristische Farbe. Fluor ist blassgelb und gasförmig, und Chlor zeigt eine gelbgrüne Farbe und ist ebenfalls gasförmig. Brom hingegen ist eine braune Flüssigkeit, und Iod präsentiert sich als schwarzviolette feste Substanz. Diese unterschiedlichen Erscheinungsbilder sind auf die Elektronenstruktur und damit verbundene Absorption von Licht in bestimmten Spektralbereichen zurückzuführen.

Unterschiedliche Farben in Lösungsmitteln
Iod zeigt ein besonders interessantes Phänomen. Während es in Alkohol braun erscheint, wechselt seine Farbe in Chloroform zu Violett. Dies liegt an der unterschiedlichen Polarität der Lösungsmittel und daran, wie Iodmoleküle mit dem Lösungsmittel interagieren, was zu Variationen in den Absorptionsspektren führt.
Atom- und Ionenradien, Schmelz- und Siedepunkte
Die Atom- und Ionenradien der Halogene nehmen von Fluor zu Iod hin zu. Das bedeutet, dass die Atome und zugehörigen Ionen größer werden. Schmelz- und Siedepunkte steigen ebenfalls in der gleichen Reihenfolge an, was auf die zunehmende Stärke der zwischenmolekularen Kräfte zurückzuführen ist. Einzigartig ist, dass die Siedepunkte von Fluorwasserstoff (HF) höher sind als erwartet, was auf die Ausbildung von Wasserstoffbrücken zurückgeht.
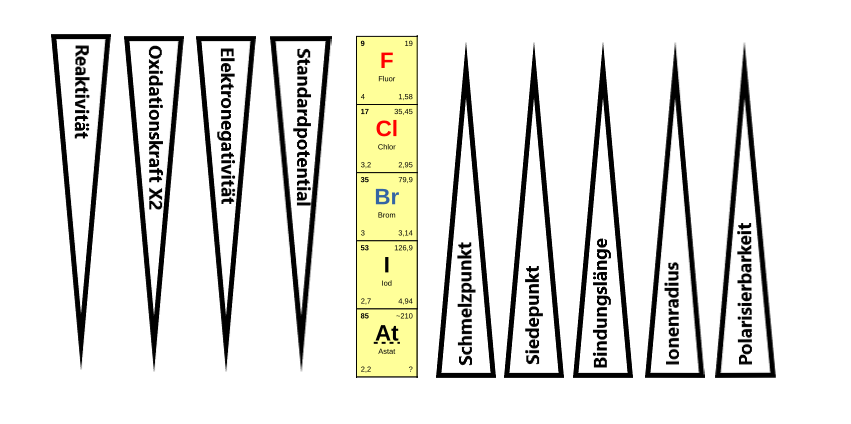
Es gibt verschiedene Beziehungen innerhalb der 7. Hauptgruppe, nach denen das IMPP gerne in den Examina fragt. Diese sind in der Grafik dargestellt.
Folgende Größen sind bei Fluor \(F\) bzw. \(F_2\) am größten und nehmen von oben nach unten ab:
- die Standardpotentiale (\(2~X^- /X_2\))
- die Elektronegativität
- die Polarität einer Bindung zwischen Kohlenstoff und Halogen (bedingt durch die Elektronegativität)
- die Oxidationskraft von \(X_2\)
Folgende Größen nehmen von oben nach unten zu:
- Schmelzpunkte
- Siedepunkte
- Bindungslängen
- Ionenradien
- Polarisierbarkeit der Elektronenhülle
Besonders zu beachten sind die außergewöhnlichen Siedepunkte von HF und die Bildung von starken Wasserstoffbrücken, die zu den hohen Siedepunkten führen.
Löslichkeit in Wasser und anderen Lösungsmitteln
Fluor und Chlor lösen sich relativ gut in Wasser, während Brom und Iod nur begrenzt löslich sind. In bestimmten organischen Lösungsmitteln können jedoch alle Halogene erfahrungsgemäß besser oder schlechter löslich sein, was bei analytischen Verfahren genutzt wird.
Geometrische Struktur von typischen Verbindungen
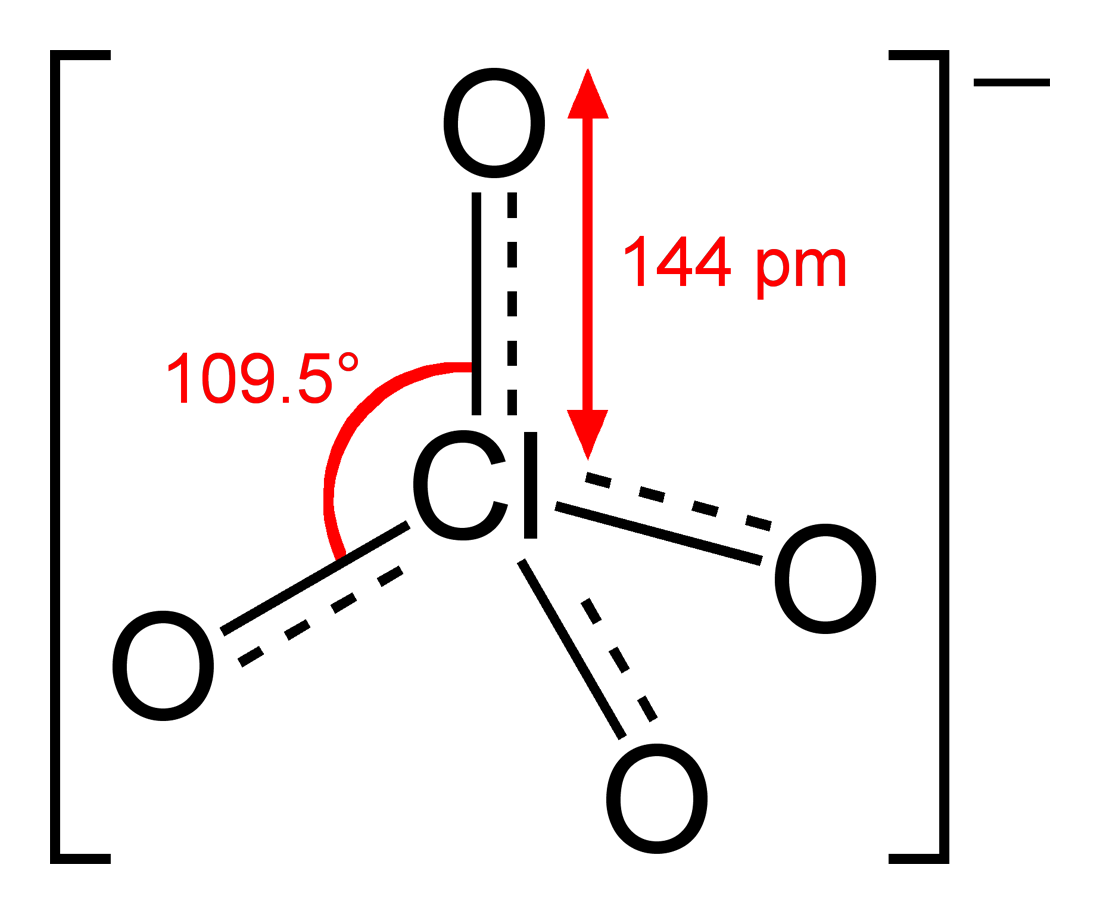
Verbindungen der Halogene wie das Perchlorat-Ion (ClO4-) mit einer tetraedrischen Struktur, Phosphortrichlorid (PCl3) mit einer trigonal-pyramidalen und Phosphorpentachlorid (PCl5) sowie PF5, die beide oktaedrisch sind, zeigen die vielfältigen geometrischen Anordnungen, die Halogenatome einnehmen können. Diese Strukturen sind durch die VSEPR-Theorie vorhersagbar.
Bindungslängen und ihre Einflüsse
Die Bindungslängen der Halogene in ihren molekularen Formen nehmen von Chlor zu Iod hin zu. Längere Bindungen sind im Allgemeinen schwächer, was bedeutet, dass die Stärke der Bindungen abnimmt. Dies hat direkte Auswirkungen auf die Reaktivität der Moleküle.
Autoprotolyse von Fluorwasserstoff
Fluorwasserstoff zeigt eine Besonderheit, die Autoprotolyse. Das bedeutet, HF kann mit sich selbst reagieren und dabei Ionen wie H2F+ und HF2- bilden. Diese Prozesse sind fundamental, um die Eigenschaften von Fluorid-Lösungen zu verstehen.
Einfluss der Elektronegativität auf die Reaktivität
Die Elektronegativität ist ein Maß dafür, wie stark ein Atom Elektronen an sich ziehen kann, und sie spielt eine zentrale Rolle bei der Bestimmung der chemischen Reaktivität. Fluor ist das elektronegativste Element und zieht Elektronen stark an, was es zu einem hervorragenden Oxidationsmittel macht. Die Elektronegativität nimmt von Fluor zu Iod hin ab, dementsprechend sinkt auch die Oxidationskraft.
Ein grundlegendes Verständnis des Trends der Elektronegativität von Fluor zu Iod und dessen Auswirkungen auf die Oxidationskraft, Acidität und Bindungsenergie ist für das IMPP von Bedeutung.
Das Verständnis dieser Themen bildet die Grundlage für ein tiefgreifendes Wissen über die Halogene und ihre Verbindungen. Besonders wichtig ist es, nicht nur die Fakten zu kennen, sondern auch die Zusammenhänge zu verstehen, um erfolgreich im Examen zu bestehen.
Reaktivität und Oxidationszahlen der Halogene
Oxidationszahlen der Halogene
Das Verständnis von Oxidationszahlen hilft dir, Reaktionen von Halogenen zu durchschauen. Fluor, als das elektronegativste Element, hat immer die Oxidationszahl -I. Das lässt sich leicht merken, denn Fluor zwingt wegen seiner hohen Elektronegativität anderen Atomen die Elektronen ab. In Chlor-, Brom- und Iodverbindungen sieht die Sache anders aus. Diese Halogene können auch positive Oxidationszahlen einnehmen, insbesondere wenn sie mit Sauerstoff verbunden sind. Denk daran: In ungeladenen Verbindungen summiert sich die Oxidationszahl zu Null. Zum Beispiel in Perchloraten (ClO₄⁻) hat Chlor die Oxidationszahl +VII.
Chlor kann in Verbindungen verschiedene Oxidationsstufen annehmen, wie +I, +III, +V und +VII. Die höchste erreicht es in Perchlorat (+VII).
Reaktivität und Stellung im Periodensystem
Die Reaktivität der Halogene wird stark von ihrer Position im Periodensystem bestimmt. Fluor, ganz oben in der Halogengruppe, ist extrem reaktiv. Die Reaktivität nimmt von Chlor über Brom zu Iod hin ab. Dieser Trend ist auf die abnehmende Elektronegativität und die erste Ionisierungsenergie zurückzuführen. Also, je weiter unten im Periodensystem, desto weniger Elektronegativität und desto geringere Oxidationskraft.
Sauerstoffsäuren und deren Salze
Verbindungen wie Chlor, Brom und Iod mit Sauerstoff bilden Sauerstoffsäuren. Diese unterscheiden sich in ihren Oxidationszahlen, was zu unterschiedlichen Säuren wie HClO (Hypochlorige Säure), HClO₂ (Chlorige Säure), HClO₃ (Chlorsäure) und HClO₄ (Perchlorsäure) führt. Ihre Salze, die Hypochlorite, Chlorite, Chlorate und Perchlorate, sind wichtig, weil sie in Reinigungsmitteln und Sprengstoffen verwendet werden.
Auf das Thema der Sauerstoffsäuren wird später noch separat eingegangen.
Iodometrie
Iodometrie ist eine quantitavie Analysemethode, die die unterschiedliche Oxidationskraft von Halogenen nutzt. In einer Redoxreaktion wird beispielsweise Iod von Chlor (einem stärkeren Oxidationsmittel) oxidiert. Diese Methode zeigt anschaulich, wie Elektronegativität und Oxidationskraft zusammenhängen.
Pseudohalogene
Erinnerst du dich an Cyanid (CN⁻) und Thiocyanat (SCN⁻)? Das sind Pseudohalogene. Sie zeichnen sich durch Eigenschaften aus, die den Halogenen ähneln, gehören chemisch gesehen aber nicht zur gleichen Gruppe. Wichtig zum Mitschreiben: Pseudohalogene können Halogenen in Reaktionen ähneln, aber oftmals ohne deren hohe Reaktivität zu zeigen.
Zusammenfassung
Feedback
Melde uns Fehler und Verbesserungsvorschläge zur aktuellen Seite über dieses Formular. Vielen Dank ❤️
Footnotes
Credits Aussehen der Halogene bei Raumtemperatur Grafik: Tomihahndorf, Halogene, CC BY-SA 3.0↩︎
Credits Beziehungen innerhalb der Halogene Grafik: Mrmw, Periodensystem newdraft, bearbeitet von MK, CC0 1.0↩︎
Credits Struktur von Perchlorat Grafik: Benjah-bmm27, Perchlorate-2D-dimensions, als gemeinfrei gekennzeichnet, Details auf Wikimedia Commons↩︎
