Silicium
IMPP-Score: 1
Silicium: Grundlagen und Bedeutung
Silicium ist das zweithäufigste Element in der Erdrinde und spielt eine zentrale Rolle in der anorganischen Chemie. Für dich als angehende Chemiker*innen ist es wichtig zu verstehen, wie Silicium in der Natur vorkommt, wie es gewonnen wird und welche einzigartigen Eigenschaften es besitzt.

Vorkommen und Gewinnung
In der Natur findet sich Silicium hauptsächlich in Verbindung mit Sauerstoff als Siliciumdioxid (SiO2), das zum Beispiel in Quarzsand vorkommt, und als Teil verschiedener Silicate - also Salzen der Kieselsäure. Für dessen Gewinnung wird Siliciumdioxid in Hochöfen mit Kohlenstoff zu metallischem Silicium reduziert.
Elektronenkonfiguration und Periodensystem
Im Periodensystem ist Silicium in der 4. Hauptgruppe und der 3. Periode zu finden. Mit 14 Protonen im Kern und der Elektronenkonfiguration \(3s^2 3p^2\) kann Silicium vier Bindungen eingehen, was seine vielfältige Chemie begründet. Die geringere Elektronegativität als Kohlenstoff führt dazu, dass Silicium-Verbindungen unterschiedliche Eigenschaften aufweisen.
Kristallstruktur und Hybridisierung
Silicium kristallisiert in der Diamantstruktur, was bedeutet, dass jedes Siliciumatom tetraedrisch von vier weiteren Siliciumatomen umgeben ist — jede Bindung ist ein Ergebnis der \(sp^3\)-Hybridisierung. Diese Anordnung ist grundlegend für die Eigenschaften von Silicium und unterscheidet es von Kohlenstoff, der auch andere kristalline Strukturen wie Graphit annehmen kann.
Die tetraedrische Koordination ist entscheidend für die Struktur vieler Siliciumverbindungen, inklusive Siliciumdioxid und Silicaten.
Siliciumdioxid (SiO2)
Das bekannteste Oxid des Siliciums ist SiO2, ein zentraler Bestandteil von Glas und vielen anderen Silicatmaterialien. Die physikalische Beschaffenheit als amorph oder kristallin ist essenziell für dessen Verwendung. Während Quarz eine kristalline Form von SiO2 ist, ist Glas amorph, entsteht durch schnelles Abkühlen von geschmolzenem SiO2 und zeigt keine regelmäßige Anordnung der Silicium- und Sauerstoffatome.
Chemische Eigenschaften von Silicium
Silicium neigt zur Bildung von Einfachbindungen, wobei die \(Si-Si\)- und \(Si-O\)-Bindungen von besonderem Interesse sind. Siliciumverbindungen wie Silane (\(Si_nH_{2n+2}\)) ähneln strukturell den Kohlenwasserstoffen, jedoch sind Si-H-Bindungen aufgrund der größeren Atomgröße und geringeren Elektronegativität des Siliciums polarer und Si-Si-Bindungen weniger stabil.
Silicium und Halogene
Die Reaktion von Silicium mit Halogenen führt zu Verbindungen wie Siliciumtetrachlorid (SiCl4). Trotz der Tetraederstruktur besitzt SiCl4 kein Dipolmoment, da die Bindungen zu den Chloratomen völlig symmetrisch sind.
Silane und Silikone
Silane können als Silicium-Analoge zu Alkanen gesehen werden, wobei sie eine ähnliche Struktur aufweisen, aber spezifische chemische Eigenschaften durch die Si-H- und Si-Si-Bindungen besitzen. Silikone sind hingegen Polymere, deren Rückgrat durch Si-O-Si-Bindungen gebildet wird und die typischerweise durch Methylgruppen (CH3) an den Siliciumatomen ergänzt werden. Polydimethylsiloxan (PDMS), eine Standardstruktur von Silikonen, wird beispielsweise aufgrund seiner chemischen und physikalischen Eigenschaften in zahlreichen Anwendungen eingesetzt.
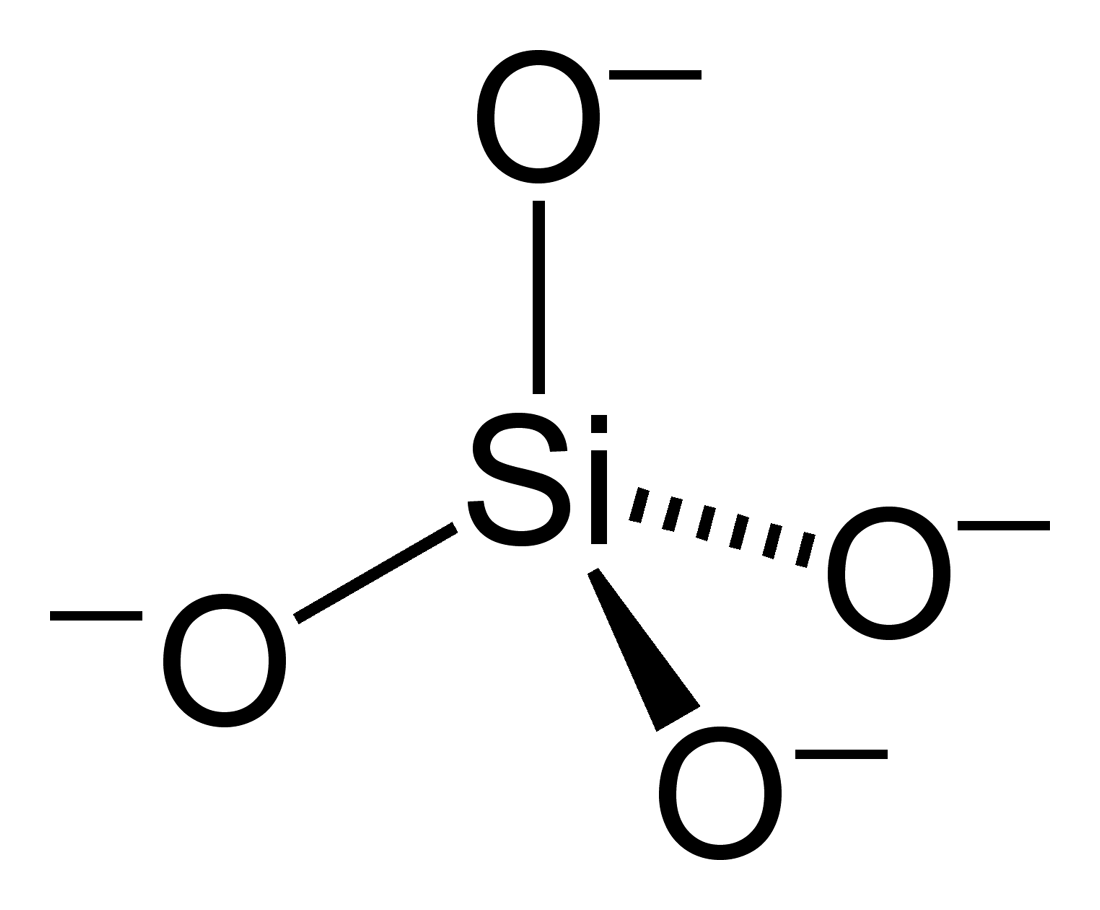
Struktur von Silikaten
Silikate sind extrem vielfältig in ihrer Struktur: Von siliciumbasierten Mineralien wie Talkum, die Schichten aus SiO4-Tetraedern bilden, bis hin zu Asbest, einem faserigen Silicat. Diese Unterschiede in der Vernetzung der SiO4-Einheiten führen zu großen Variationen in den physikalischen und chemischen Eigenschaften.
Relevanz für die Prüfung
Das IMPP fragt besonders gerne nach der tetraedrischen Koordination und den grundlegenden Strukturen von Siliciumverbindungen wie SiO2, Silanen und Silikonen. Auch die Unterschiede in den Eigenschaften und Reaktionsweisen im Vergleich zu Kohlenstoff stehen oft im Fokus.
\(SiO2\) ist das Anhydrid der Orthokieselsäure (\(Si(OH)_4\)) und spielt eine zentrale Rolle bei der Transformation in Silicate, beispielsweise durch Schmelzen mit Natriumhydroxid.
Borosilicatglas zeichnet sich durch den Ersatz von Silicium durch Bor in seiner Struktur aus, was sowohl die thermischen als auch mechanischen Eigenschaften verbessert, was besonders in Laborgeräten geschätzt wird.
Verinnerlicht diese Konzepte gut, denn sie sind fundamental für ein tiefgreifendes Verständnis der Chemie des Siliciums und seiner vielfältigen Anwendungen in der Welt um uns herum.
Zusammenfassung
Feedback
Melde uns Fehler und Verbesserungsvorschläge zur aktuellen Seite über dieses Formular. Vielen Dank ❤️
Footnotes
Credits Silicium Grafik: Th. Voekler, Silicon Si, CC BY-SA 3.0↩︎
Credits Kristallstruktur von Silicium Grafik: Michel Bakni creator QS:P170,Q81411358, Silicon Crystal structure, CC BY-SA 4.0↩︎
Credits Struktur von Silikat Grafik: Benjah-bmm27, Silicate-tetrahedron-2D, als gemeinfrei gekennzeichnet, Details auf Wikimedia Commons↩︎