Puffer
IMPP-Score: 0.8
Puffersysteme und ihre Anwendung
Ein Puffersystem ist eine Lösung, die eine schwache Säure und ihre konjugierte Base oder eine schwache Base und deren konjugierte Säure enthält. Das Herzstück des Puffersystems ist die Fähigkeit, den pH-Wert der Lösung weitgehend konstant zu halten, auch wenn Säuren oder Basen hinzugefügt werden. Puffer sind unverzichtbar für viele biochemische Prozesse, insbesondere in lebenden Organismen, wo ein stabiler pH-Wert für die Funktion von Enzymen und die Aufrechterhaltung des Stoffwechsels entscheidend ist.
Phosphat-Puffersystem in biochemischen Prozessen
Ein klassisches Beispiel für ein Puffersystem ist das Phosphat-Puffersystem. Es besteht aus einer Mischung aus sauren (H2PO4-) und basischen (HPO4^2-) Phosphaten. Diese können, je nach pH-Wert ihrer Umgebung, Protonen (H+) aufnehmen oder abgeben.
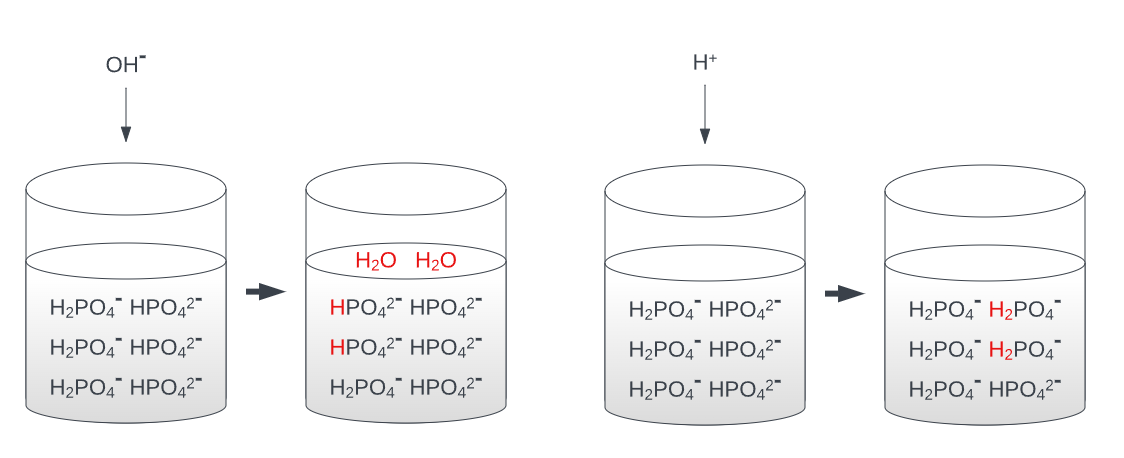
Das Konzept der Puffer und ihr Verhalten bei Säure- und Basezusatz ist in der Grafik dargestellt.
Das IMPP fragt besonders gerne nach der Funktionsweise und Bedeutung von Puffersystemen in biologischen Kontexten.
Das Prinzip der Pufferwirkung
Starke Säuren und Basen sind für Pufferlösungen nicht geeignet, da sie im Wasser vollständig dissoziieren und dadurch den pH-Wert bedeutend verschieben würden. Bei schwachen Säuren bzw. Basen wird nur ein Teil in Ionen dissoziiert, der andere Teil bleibt unverändert, was die Grundlage für ihre Pufferwirkung bildet.
Henderson-Hasselbalch-Gleichung
Die Henderson-Hasselbalch-Gleichung ist zentral für das Verständnis von Puffersystemen:
\[ pH = pKa + \log\left(\frac{[A-]}{[HA]}\right) \]
Diese Gleichung verbindet den pH-Wert einer Pufferlösung mit dem Verhältnis von konjugierter Base (\([A-]\)) zu Säure (\([HA]\)) und dem pKa-Wert der Säure.
Maximale Pufferkapazität
Die Pufferkapazität gibt an, wie gut eine Lösung gegen pH-Änderungen durch die Zugabe von Säuren oder Basen geschützt ist. Sie ist am höchsten, wenn die Konzentrationen von Säure und konjugierter Base äquimolar sind. In diesem Zustand entspricht der pH-Wert des Puffers dem pKa-Wert der schwachen Säure.
Bei äquimolaren Mengen von Säure und konjugierter Base erreicht der Puffer seine maximale Kapazität und der pH-Wert entspricht dem pKa-Wert der schwachen Säure.
Beispiele für Puffersysteme
- Acetat-Puffer: Er besteht aus Essigsäure (CH3COOH) und ihrem Salz, Natriumacetat (CH3COONa).
- Ammoniak-Puffer: Dieser Puffer umfasst Ammoniak (NH3) und das korrespondierende Salz Ammoniumchlorid (NH4Cl).
- Carbonat-Puffer: Bicarbonat (HCO3-) und Kohlensäure (H2CO3) bilden diesen wichtigen Puffer, der auch in unserem Blut vorkommt.
Das Konzept der Pufferkapazität und wie sie sich bei Verdünnung ändert, ist ebenfalls wichtig. Bei Verdünnung bleibt der pH-Wert nahezu unverändert, aber die Fähigkeit des Puffers, pH-Änderungen zu widerstehen – die Pufferkapazität – nimmt ab.
Bedeutung von Puffern in physiologischen Systemen
Puffer sind essentiell für den menschlichen Körper. Blut enthält mehrere Puffersysteme, darunter das Carbonat- und Phosphat-Puffersystem, um den pH-Wert konstant zu halten, was für lebenswichtige Prozesse notwendig ist.
Denkt daran, dass Puffersysteme in biologischen Systemen, insbesondere im Blut und bei Stoffwechselprozessen, eine außerordentlich wichtige Rolle spielen. Ihr Verständnis ist also nicht nur für das Examen sondern auch für das Verständnis des Lebens selbst kritisch.
Indem Du die Grundlagen und Beispiele von Puffern studierst, wirst Du besser in der Lage sein, komplexe Fragen zu Puffersystemen und ihren Anwendungen im biologischen Kontext zu beantworten, wie sie oft vom IMPP gestellt werden.
Zusammenfassung
Feedback
Melde uns Fehler und Verbesserungsvorschläge zur aktuellen Seite über dieses Formular. Vielen Dank ❤️
Footnotes
Credits Pufferwirkung bei Base- und Säurezusatz Grafik: Tttrung, Buffer solution (base), CC BY-SA 4.0↩︎
