Reaktive Sauerstoffspezies
IMPP-Score: 0.8
Reaktive Sauerstoffspezies (ROS)
Reaktive Sauerstoffspezies, kurz ROS, sind eine Gruppe von Molekülen und Radikalen, die durch ihre hohe Reaktivität in biologischen und chemischen Systemen auffallen. Diese Moleküle können als Oxidationsmittel fungieren und wichtige Rollen in verschiedenen biologischen und chemischen Prozessen spielen. Im Folgenden werden wir uns auf die spezifischen Eigenschaften und Unterschiede zwischen Singulett-Sauerstoff, Superoxid-Radikal und Hydroxylradikal konzentrieren.
Triplett-Sauerstoff
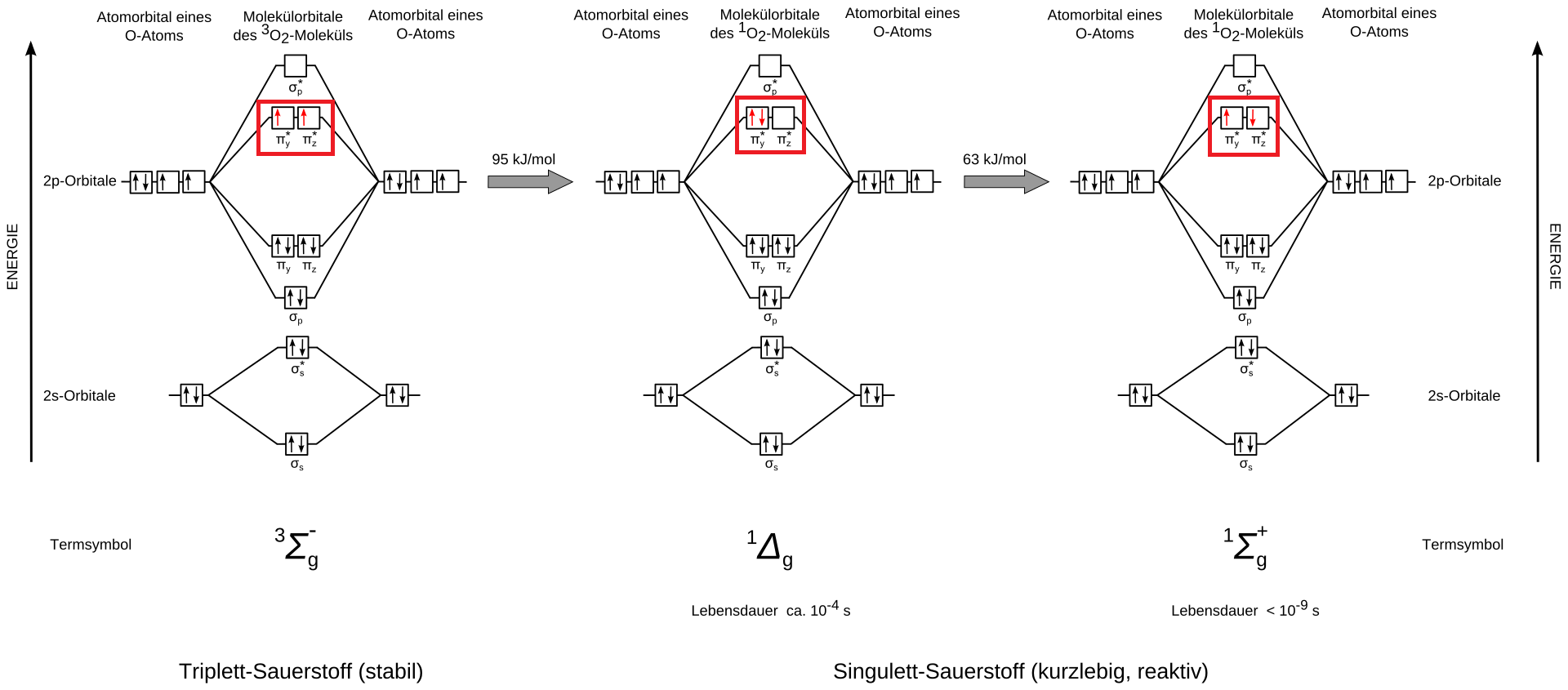
Der Triplett-Sauerstoff ist die Form, die du einatmest, und sie wird als Triplett-Sauerstoff bezeichnet, da sie zwei ungepaarte Elektronen mit parallelem Spin enthält. Technisch gesehen ist der Triplett-Sauerstoff keine reaktive Sauerstoffspezies, wird hier allerdings wegen des Unterschieds zum Singulett-Sauerstoff aufgeführt. Triplett-Sauerstoff hat insgesamt 12 Valenzelektronen, von denen jedes einzelne Sauerstoffatom 6 Valenzelektronen beiträgt. Die Elektronenkonfiguration führt zu einem paramagnetischen Verhalten, was bedeutet, dass Triplett-Sauerstoff von einem Magnetfeld angezogen wird, eine Eigenschaft, die man sich in der Medizin beim Funktionieren von MRT-Geräten zunutze macht.
Triplett-Sauerstoff ist auch deswegen besonders stabil und häufig auf der Erde, weil seine Elektronen eine energetisch begünstigte Anordnung nach der Hundschen Regel einnehmen, bei der die Elektronen die gleiche Spinorientierung haben und in unterschiedlichen Orbitalen untergebracht sind.
Wichtiges Merkmal des Triplett-Sauerstoffs
Triplett-Sauerstoff ist wegen seiner parallelen Spinrichtung zweier Elektronen paramagnetisch und stellt die häufigste Form von Sauerstoff auf der Erde dar.
Singulett-Sauerstoff (1O2)
Bei Singulett-Sauerstoff handelt sich um einen angeregten Zustand von Sauerstoff, in dem die Elektronen eine höhere Energie aufweisen und parweise in denselben Orbitalen mit antiparallelen Spins angeordnet sind. Dies macht Singulett-Sauerstoff viel reaktiver als Triplett-Sauerstoff. Er kann durch verschiedene chemische Reaktionen oder Bestrahlung mit Licht entstehen und spielt eine Rolle in verschiedenen chemischen Prozessen, zum Beispiel bei der Oxidation von Anthrahydrochinon zu Wasserstoffperoxid oder in photodynamischen Therapien. Singulett-Sauerstoff hat allerdings durch seine höhere Energie nur eine sehr kurze Lebensdauer.
Elektronenkonfiguration und Energiezustände
Singulett-Sauerstoff besitzt zwei Elektronenzustände:
- Einen energieärmeren Zustand (1Δg), bei dem beide Elektronen ein Orbital belegen und antiparallelen Spin aufweisen.
- Einen energiereicheren Zustand (1Σg+), in dem die Elektronen in getrennten Orbitalen liegen.
Die Kenntnis über die Elektronenkonfiguration ist entscheidend, um die höhere Reaktivität gegenüber Triplett-Sauerstoff zu verstehen und die Molekülorbitalschemata korrekt zuzuordnen.
Im Gegensatz zum Triplett-Sauerstoff, der zwei ungepaarte Elektronen in unterschiedlichen Orbitalen besitzt und paramagnetisch ist, sind bei Singulett-Sauerstoff die Elektronen gepaart und im angeregten Zustand, was sein diamagnetisches Verhalten erklärt.
Reaktivität von Singulett-Sauerstoff
Die gepaarten Elektronen im Singulett-Sauerstoff sind angeregt, was ihn reaktiver als den stabileren Triplett-Sauerstoff macht. Seine höhere Reaktivität finden wir beispielsweise bei der Oxidation von Biomolekülen wieder.
Vergleich Triplett- und Singulett-Sauerstoff
Der Unterschied zwischen Triplett- und Singulett-Sauerstoff ist gut in diesem Molekülorbitaldiagramm dargestellt:
Superoxid-Radikal (O2-)
Das Hyperoxid- oder Superoxid-Anion (O2-) ist eine weitere bedeutsame ROS. Es entsteht durch die Aufnahme eines zusätzlichen Elektrons im Vergleich zum diatomischen Sauerstoff.
Bildung und Eigenschaften von Superoxid-Radikalen
Durch die Zugabe eines zusätzlichen Elektrons auf das Sauerstoffmolekül wird das Superoxid-Radikal zu einem Paramagnet. Dieses zusätzliche Elektron macht das Molekül deutlich reaktiver als gewöhnlichen Sauerstoff.
Hydroxylradikal (OH•)
Das Hydroxylradikal, OH•, ist wahrscheinlich die reaktivste aller ROS.
Entstehung und Reaktivität von Hydroxylradikalen
Das Hydroxylradikal kann durch energiereiche Prozesse wie UV-Strahlung aus Wasserstoffperoxid entstehen. Aufgrund seiner extremen Reaktivität spielt es eine wichtige Rolle bei der Schädigung von Biomolekülen.
Bedeutung von ROS
Reaktive Sauerstoffspezies sind in der Chemie von großer Wichtigkeit. In biomedizinischen Bereichen beeinflussen sie unter anderem die Signalübertragung in Zellen und können zu Schäden an Biomolekülen führen.
Das IMPP fragt besonders gerne nach der Unterscheidung zwischen verschiedenen ROS-Formen, ihrer Elektronenspin-Konfiguration und Bedeutung für biologische Systeme.
Für eine vertiefte Auseinandersetzung mit diesem Thema sind Molekülorbitalschemata und Vergleiche der elektronischen Konfigurationen besonders hilfreich, um die Eigenschaften und das Reaktionsverhalten dieser Moleküle zu verstehen.
Zusammenfassung
Feedback
Melde uns Fehler und Verbesserungsvorschläge zur aktuellen Seite über dieses Formular. Vielen Dank ❤️
Footnotes
Credits Molekülorbitaldiagramm von Triplett- und Singulett-Sauerstoff Grafik: Muskid, MO O2, CC BY-SA 3.0↩︎
