Metallische Bindung
IMPP-Score: 0.9
Metallische Bindung und ihre Eigenschaften
Die metallische Bindung ist ein zentrales Konzept in der Chemie, insbesondere wenn es um die Eigenschaften und das Verhalten von Metallen geht. Um euch gut auf das Examen vorzubereiten, ist es wichtig, die Details zu verstehen und wie diese Bindungsart die charakteristischen Eigenschaften von Metallen bedingt.
Das Elektronengas-Modell
Metalle bestehen aus einem Kristallgitter positiv geladener Metallionen, die von einem “Meer” aus delokalisierten Elektronen umgeben sind. Diese frei beweglichen Valenzelektronen wird oft als Elektronengas beschrieben. Stellt euch das vor wie ein Rumpfgitter, in dem die Kationen fest verankert sind, während die Elektronen sich relativ frei zwischen ihnen bewegen können.
Die freie Beweglichkeit der Elektronen ist essentiell für die hohe elektrische Leitfähigkeit der Metalle.
Bandstruktur und elektrische Leitung
Metalle haben überlappende Energiebänder – das Valenzband und das Leitungsband. Bei Metallen sind diese Bänder so geformt, dass Elektronen leicht in das Leitungsband gelangen und somit zur Leitung beitragen können. Die elektrische Leitfähigkeit der Metalle sinkt allerdings mit steigender Temperatur – erinnert euch, das IMPP fragt besonders gerne nach solchen Zusammenhängen!
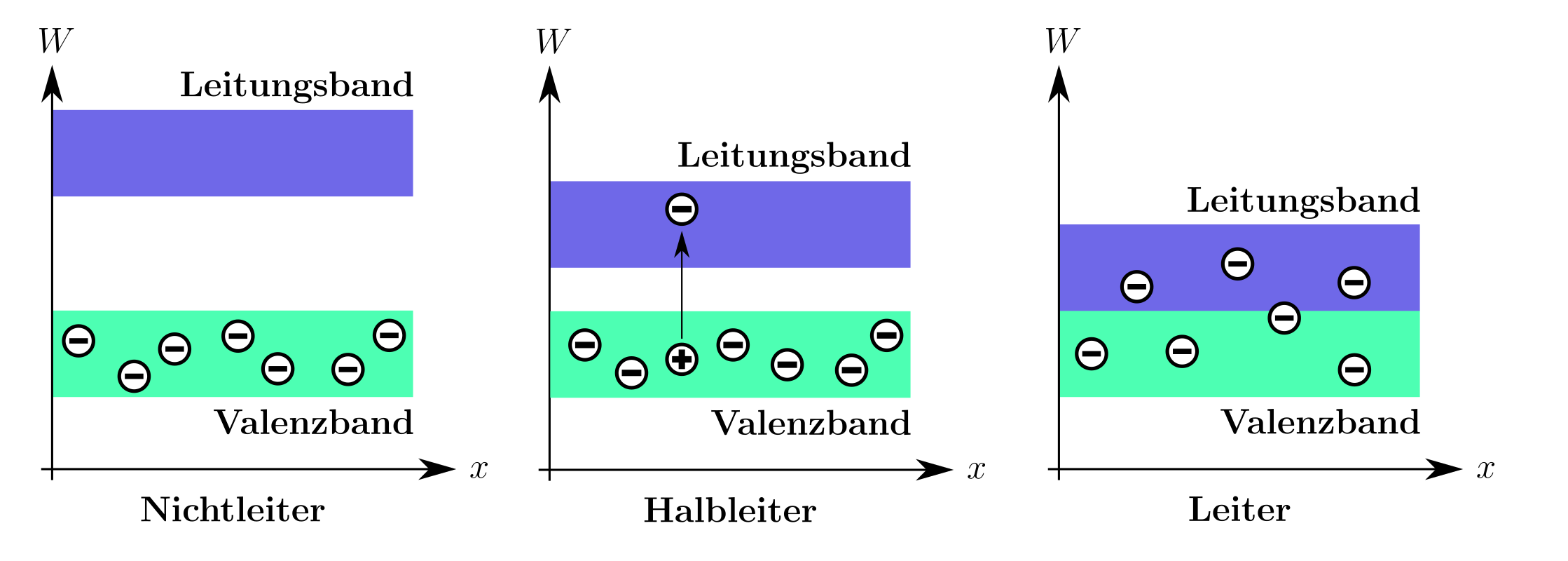
Achtung: Diese Regel gilt nicht für Halbleiter, bei denen eine Temperaturerhöhung die Leitfähigkeit oftmals verbessert.
Wärmeleitfähigkeit und metallischer Glanz
Dass Metalle Wärme gut leiten, liegt ebenfalls am Elektronengas, das Energie effizient über das Gitter verteilen kann. Der metallische Glanz entsteht durch Reflexion von Lichtstrahlen an den dicht gepackten Atomen des Metallgitters.
Legierungen und ihre Eigenschaften
Legierungen wie Messing (Kupfer und Zink) und Bronze (Kupfer und Zinn) entstehen, indem verschiedene Metalle ihre Valenzelektronen teilen und ein gemeinsames Elektronengas bilden. Dies verändert die physikalischen Eigenschaften, etwa die Härte oder die Korrosionsbeständigkeit.
Die Fähigkeit, sich zu dehnen und zu verbiegen (Duktilität), hängt mit der Tatsache zusammen, dass Metallionen im Gitter verschoben werden können, ohne dass das Metall bricht.
Verhalten bei niedrigen Temperaturen
Interessant ist auch das Verhalten von Metallen bei niedrigen Temperaturen: Der Widerstand sinkt oft, was in Superleitern extrem ausgeprägt ist – dies sind Materialien, die unter bestimmten Temperaturen den elektrischen Strom ohne Widerstand leiten.
Merkt euch, dass Metalle aufgrund ihres Elektronengases viele einzigartige Eigenschaften haben, die durch das Modell des Rumpfgitters und die Beweglichkeit der Elektronen erklärbar sind. Das IMPP könnte daher Beispiele anführen, anhand derer ihr die Prinzipien der elektrischen Leitfähigkeit, der Wärmeleitung und der mechanischen Eigenschaften von Metallen und Legierungen erläutern sollt. Seid also vorbereitet, tief in die Materie einzusteigen!
Zusammenfassung
Feedback
Melde uns Fehler und Verbesserungsvorschläge zur aktuellen Seite über dieses Formular. Vielen Dank ❤️
Footnotes
Credits Elektronengasmodell der metallischen Bindung Grafik: ARTE, Nuvola di elettroni, als gemeinfrei gekennzeichnet, Details auf Wikimedia Commons↩︎
Credits Valenzbandmodell der metallischen Bindung Grafik: Johannes Schneider, Bändermodell eines Nichtleiters mit Leitungsband und Valenzband, CC BY-SA 4.0↩︎
