Elektrophile Addition an Doppel- und Dreifachbindung
IMPP-Score: 1.3
Elektrophile Addition an Doppel- und Dreifachbindungen
Die elektrophile Addition ist ein grundlegender Reaktionsmechanismus in der organischen Chemie, der entscheidend für das Verständnis vieler Reaktionen ist, die in eurem Examen vorkommen können. Hier konzentrieren wir uns auf die Details dieses Mechanismus, die Regio- und Stereoselektivität sowie spezifische Regeln wie die Regel nach Markownikow.
Konzept der elektrophilen Addition
Ein Elektrophil ist ein reaktives Partikel mit einem Elektronenmangel, das daher in der Lage ist, ein Elektronenpaar zu akzeptieren. Mehrfachbindungen, wie die Doppelbindung in Alkenen und die Dreifachbindung in Alkinen, sind besonders reaktionsfreudig gegenüber Elektrophilen, da sie über eine hohe Elektronendichte verfügen.
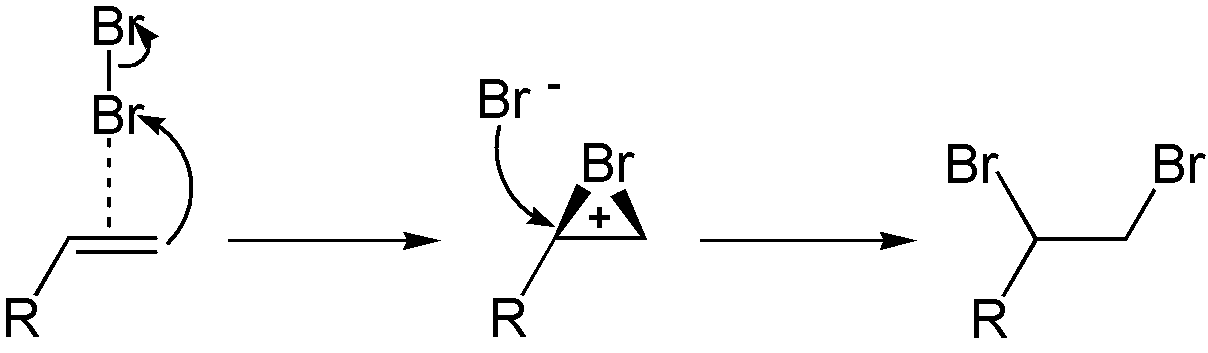
Bei der elektrophilen Addition nähert sich ein Elektrophil der Mehrfachbindung und bildet mit einem der Kohlenstoffatome eine neue Bindung. Dies führt zur Bildung eines positiv geladenen Intermediats, welches in einer zweiten Stufe durch ein Nukleophil angegriffen wird, um das Additionsprodukt zu bilden.
Reaktionsmechanismen
Mechanismen der Addition
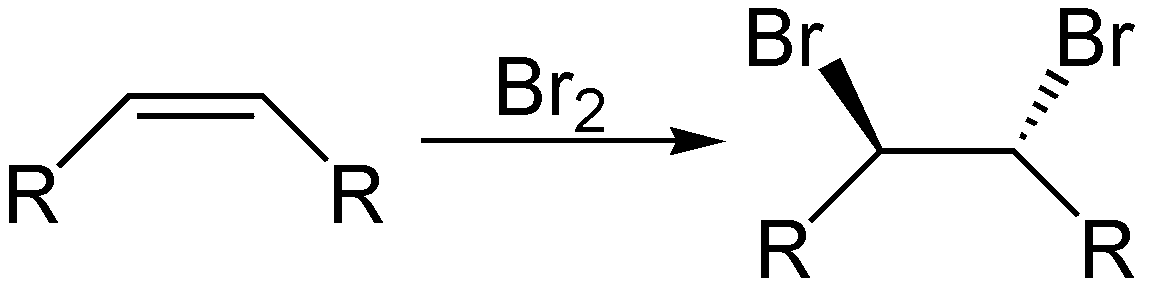
- Bei der Bromierung von Alkenen nähert sich beispielsweise ein Brommolekül der Doppelbindung. Ein Bromatom wird zum Elektrophil und bildet mit einem der Kohlenstoffatome der Doppelbindung eine neue Bindung, woraus ein Bromonium-Ion entsteht. Das andere Bromatom kommt als Bromid-Ion zurück und greift das Bromonium-Ion von der gegenüberliegenden Seite an (anti-Addition), was zu einer Vicinaldibromverbindung führt.
- Die Hydrierung mit Metallkatalysatoren erfolgt syn-selektiv. Die Metall-Oberfläche adsorbiert Wasserstoffatome, welche dann gleichzeitig von der gleichen Seite an die Doppelbindung des Alkens addiert werden.
- Bei der Addition von Wasserstoffhalogeniden folgt die Reaktion oft der Regel nach Markovnikov, wobei das Protische Säure-Teilchen, also der Wasserstoff, bevorzugt an das kohlenstoffärmere Ende der Doppelbindung addiert wird.
Dynamische Aspekte
Ein gutes Beispiel für Temperaturabhängigkeit sind die 1,2- oder 1,4-Additionen an konjugierte Diene wie Buta-1,3-Dien. Hier wird bei niedriger Temperatur die kinetisch kontrollierte 1,2-Addition bevorzugt, während bei höheren Temperaturen die thermodynamisch stabile 1,4-Addition dominiert.
Spezielle Reaktionsbedingungen
- Die osmiumtetroxid-vermittelte Dihydroxylierung führt zu Vicinaldiolen, indem OsO4 an die Doppelbindung addiert und anschließend mit einem Reduktionsmittel wie Natriumthiosulfat umgesetzt wird.
- Während der Ozonolyse addiert Ozon an eine Doppelbindung und spaltet diese anschließend auf, um zwei Carbonylverbindungen zu bilden.
Regio- und Stereoselektivität
Regel nach Markownikow
Die Regel nach Markownikow besagt, dass bei der elektrophilen Addition von protischen Säuren an unsymmetrische Alkene das protonierte Elektrophil (H+) bevorzugt an das kohlenstoffärmere Ende der Doppelbindung addiert wird, da sich hierdurch ein stabileres Carbeniumion bildet.
Bei Prüfungsfragen vom IMPP ist es besonders wichtig, diese Regel und ihre Anwendung auf verschiedene Reaktionen zu verstehen.
Stereoselektivität und ihre Auswirkungen
Die Stereoselektivität bei Reaktionen wie der Bromierung zeigt sich in der Art und Weise, wie das Bromonium-Ion gebildet und das Nukleophil angelagert wird. Dies führt entweder zu syn- oder zu anti-Additionen und damit verbundenen stereochemischen Konsequenzen für das Produkt.
Spezielle Reaktionen und Ausnahmen
Diels-Alder-Reaktion
Die Diels-Alder-Reaktion ist ein wichtiges Beispiel einer nicht-elektrophilen Additionsreaktion, bei der ein konjugiertes Dien mit einem Alken oder Alkin (Dienophil) unter Bildung eines Cyclohexens reagiert. Im Gegensatz zu elektrophilen Additionen handelt es sich hier um eine pericyclische Reaktion, die durch orbitale Wechselwirkungen gesteuert wird.
Radikalische Additionen
Bei radikalischen Additionen wird die Markownikow-Regel invertiert, und es können beispielsweise anti-Markownikow-Produkte entstehen.
Zusammenfassung
Feedback
Melde uns Fehler und Verbesserungsvorschläge zur aktuellen Seite über dieses Formular. Vielen Dank ❤️
Footnotes
Credits Überblick über die elektrophile Addition an die Mehrfachbindung Grafik: Eschenmoser, Stereo-Add-Brom-Alken, als gemeinfrei gekennzeichnet, Details auf Wikimedia Commons↩︎
Credits Detaillierter Mechanismus der elektrophilen Addition an die Mehrfachbindung Grafik: Eschenmoser, Addition-Brom-Alken, als gemeinfrei gekennzeichnet, Details auf Wikimedia Commons↩︎
Credits Markownikow-Regel Grafik: Lisa1223S, Beispiel Markownikow, CC BY-SA 4.0↩︎
