Nucleophile Addition an die CC-Mehrfachbindung
IMPP-Score: 0.4
Nucleophile Addition an die C≡C-Mehrfachbindung
Die nucleophile Addition an die sp-hybridisierte C≡C-Mehrfachbindung ist eine grundlegende Transformation in der organischen Chemie. Hier tritt ein Nucleophil mit einem Kohlenstoffatom einer Dreifachbindung in Reaktion, wodurch die lineare sp-Hybridisierung aufgebrochen und in eine sp^2- oder sp^3-Hybridisierung überführt wird. Dies führt zu neuen Bindungen am reagierenden Kohlenstoffatom.
Der Mechanismus sieht folgendermaßen aus:
- Das Nucleophil nähert sich dem elektronenarmen, sp-hybridisierten Kohlenstoffatom der Dreifachbindung.
- Unter Ausbildung einer neuen σ-Bindung bildet sich ein Carbanion-Intermediat.
- Durch eine Protonenaufnahme durch das Carbanion wird die Reaktion abgeschlossen und es entsteht ein substituiertes Alken oder Alkan.
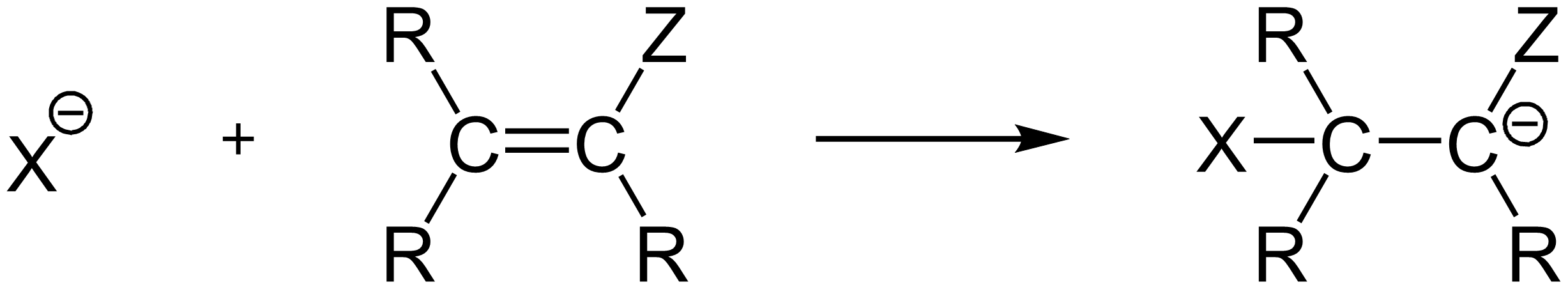
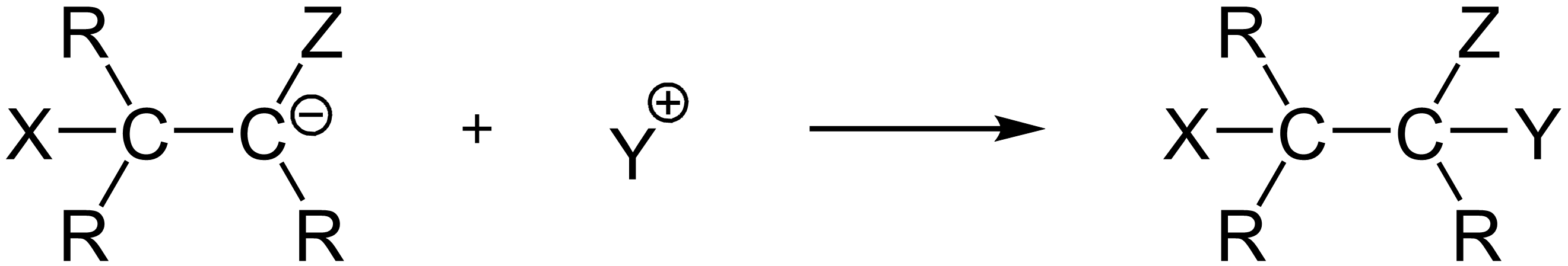
Das IMPP fragt besonders gerne nach dem Verständnis des Mechanismus und den Folgeprodukten der nucleophilen Addition an C≡C-Mehrfachbindungen. Achtet also auf die Details des Angriffs und die Stabilisierung der Intermediaten.
Michael-Addition
Die Michael-Addition stellt eine spezielle Form der 1,4-nucleophilen Addition dar. Ein Enolat-Ion greift hierbei eine α,β-ungesättigte Carbonylverbindung an ihrer β-Position an und bildet ein neues C-C-Zentrum. Der Mechanismus umfasst:
- Deprotonierung des α-C-Atoms nahe der Carbonylkette, um das Enolat-Ion zu generieren.
- Nucleophiler Angriff des Enolats auf das β-C-Atom der α,β-ungesättigten Verbindung.
- Bildung eines neuen C-C-Zentrums nach Eintritt des Nucleophils.
Das Elektrophil in einer Michael-Addition weist häufig einen Carbonylrest auf, der das Enolat-Ion stabilisieren kann. Behaltet die geometrischen Veränderungen im Molekül und die Auswirkungen auf das Produkt im Gedächtnis.
Robinson-Anellierung
Die Robinson-Anellierung ist eine Konvergenz von Michael-Addition und Aldol-Kondensation, die üblicherweise in der Naturstoffsynthese verwendet wird. Der Ablauf ist wie folgt:
- Bildung eines Enolat-Ions aus einem Molekül mit einer aktiven Methylen- oder Methin-Gruppe durch Deprotonierung.
- Michael-Addition des Enolats an ein α,β-ungesättigtes Carbonyl-Elektrophil.
- Intramolekulare Aldol-Kondensation, die letztlich zu einem kondensierten Ringsystem führt.
Das IMPP interessiert sich für das Verständnis der Robinson-Anellierung als sequenzielle Reaktionsfolge und die Fähigkeit, die beteiligten Intermediaten korrekt zu identifizieren.
Zusammenfassung
Feedback
Melde uns Fehler und Verbesserungsvorschläge zur aktuellen Seite über dieses Formular. Vielen Dank ❤️
Footnotes
Credits Erster Teil des Reaktionsmechanismus Grafik: The original uploader was Thiesi at German Wikipedia., Nucladd1, CC BY-SA 3.0↩︎
Credits Zweiter Teil des Reaktionsmechanismus Grafik: The original uploader was Thiesi at German Wikipedia., Nucladd2, CC BY-SA 3.0↩︎
Credits Mechanismus der Michael-Addition Grafik: Eva1900, Mechanismus Michael addition V1, CC0 1.0↩︎
