Katalyse
IMPP-Score: 0.5
Einfluss von Katalysatoren auf Reaktionskinetik und chemische Prozesse
Ein Katalysator ist eine Substanz, die die Geschwindigkeit einer chemischen Reaktion erhöht, ohne dabei selbst verbraucht zu werden oder die Gleichgewichtskonstante der Reaktion zu verändern.
Wirkweise eines Katalysators
Ein Katalysator ermöglicht eine Reaktion entlang eines energetisch günstigeren Pfades und senkt somit die freie Aktivierungsenthalpie \(\Delta G^*\) einer Reaktion. Dies sorgt für eine höhere Reaktionsgeschwindigkeit, weil eine geringere energetische Barriere überwunden werden muss, damit die Reaktion stattfinden kann. Interessant für dich könnte sein, dass das IMPP häufig nach den Konzepten der Aktivierungsenergie und freien Aktivierungsenthalpie fragt.
Autokatalyse
Was ist Autokatalyse?
Bei einer autokatalytischen Reaktion fungiert das Reaktionsprodukt als Katalysator für die eigene Bildung. Dies führt zu einer positiven Rückkopplung, da die anfängliche Reaktionsrate durch die zunehmende Konzentration des Produkts, welches als Katalysator wirkt, kontinuierlich beschleunigt wird. Du solltest verstehen, dass die Autokatalyse zwar die Reaktionsgeschwindigkeit erhöht, aber nicht das Prinzip der Katalyse als solches verletzt – die Gleichgewichtslage bleibt unberührt.
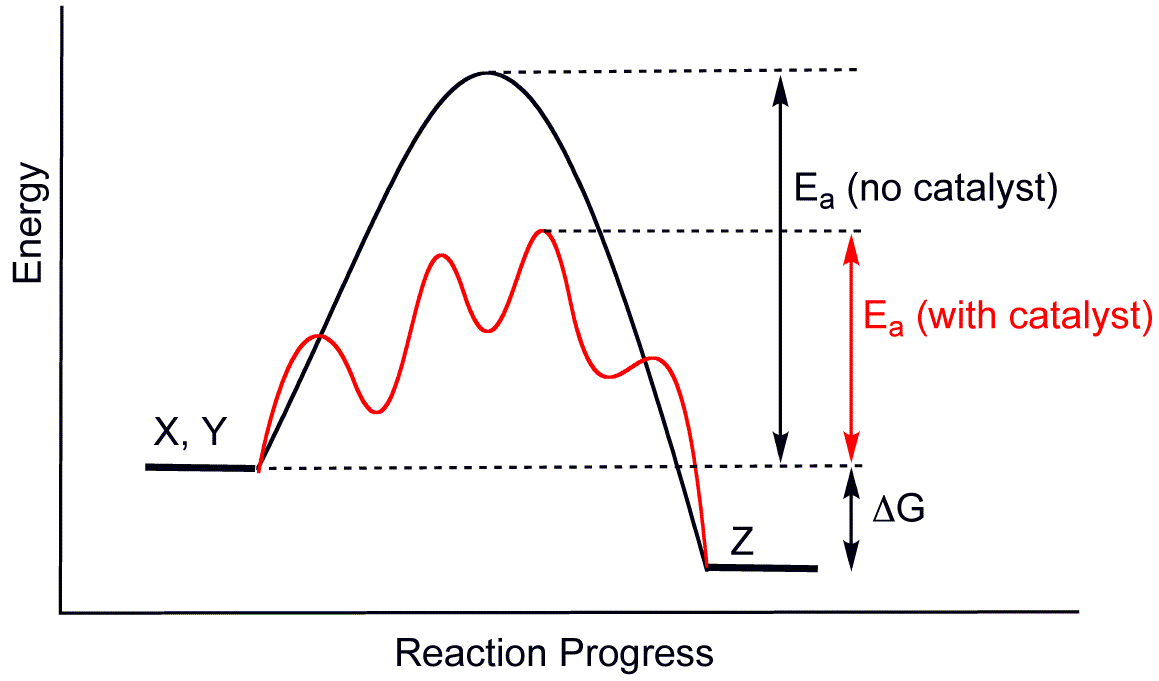
Katalysatoren und Reaktionsenergiediagramme
Katalysatoren verringern die Aktivierungsenergie und ermöglichen so neue Reaktionswege mit niedrigeren energetischen Barrieren. Dieser Effekt wird in Reaktionsenergiediagrammen sichtbar.
Anhand von Reaktionsenergiediagrammen lassen sich die Veränderungen der Aktivierungsenergie durch die Anwesenheit eines Katalysators gut darstellen. Die Energieniveaus der Edukte und Produkte bleiben gleich, die Aktivierungsenergie wird jedoch deutlich niedriger. Denke daran, dass das IMPP besonders gerne den Unterschied in der Aktivierungsenergie vor und nach der Zugabe eines Katalysators abfragt.
Homogene und heterogene Katalyse
Katalysatoren können nach dem Aggregatzustand, in dem sie auftreten, in homogene und heterogene Katalysatoren unterteilt werden.
Homogene Katalyse
Bei der homogenen Katalyse befindet sich der Katalysator im gleichen Aggregatzustand wie die Reaktanden. Dies ermöglicht eine bessere Mischung und Wechselwirkung, wodurch Reaktionen schneller erreicht werden können.
Heterogene Katalyse
Im Gegensatz dazu liegt bei der heterogenen Katalyse der Katalysator in einem anderen Aggregatzustand als die Reaktanden vor. Ein typisches Beispiel ist ein fester Katalysator, über den ein gasförmiger Reaktand strömt. Die Wechselwirkungen an der Phasengrenzfläche spielen hier eine entscheidende Rolle.
Katalyse in lebenswichtigen Prozessen
In biologischen Systemen übernehmen Enzyme die Rolle von Katalysatoren und sind entscheidend für das Leben, da sie biochemische Reaktionen beschleunigen.
Katalysatoren sind von enormer Bedeutung in der chemischen Industrie und tragen dort zu Effizienz und Nachhaltigkeit bei, indem sie Reaktionszeiten verkürzen und Energie einsparen.
Einflussnahme auf Selektivität
Durch den Einsatz von Katalysatoren kann auch die Selektivität einer Reaktion beeinflusst werden, was bedeutet, dass gezielt bestimmte Produkte bevorzugt gebildet werden. Dieses Prinzip ist besonders wichtig für die pharmazeutische Chemie und die Herstellung feinchemischer Produkte.
Wrap-Up
Katalysatoren spielen eine zentrale Rolle in der Chemie, weil sie die Reaktionskinetik beeinflussen, ohne die Gleichgewichtsverhältnisse zu stören. Sie ermöglichen ökonomischere und ökologischere Verfahren, sowohl in der industriellen Chemie als auch in lebenswichtigen biochemischen Prozessen. Das gründliche Verständnis der Wirkweise von Katalysatoren ist daher unentbehrlich und wird dir im Examen sicher begegnen.
Zusammenfassung
Feedback
Melde uns Fehler und Verbesserungsvorschläge zur aktuellen Seite über dieses Formular. Vielen Dank ❤️
Footnotes
Credits Reaktionsdiagramm mit und ohne Katalysator Grafik: Autor unbekannt. Smokefoot assumed (based on copyright claims)., CatalysisScheme, als gemeinfrei gekennzeichnet, Details auf Wikimedia Commons↩︎
