Stabilität und Reaktivität
IMPP-Score: 0.4
Stabilität und Reaktivität von Komplexverbindungen
Die Stabilität eines Komplexes kann auf eine ansprechende Art und Weise mit einem Haus verglichen werden: Je stärker das Fundament und die Verbindungen der Bausteine, desto stabiler das Gebäude. In der Welt der Chemie sind die “Bausteine” Liganden und Zentralionen, und das “Fundament” ist die Wechselwirkung zwischen ihnen.
Thermodynamische Stabilität und Komplexbildungskonstante
Die thermodynamische Stabilität eines Komplexes wird maßgeblich durch die Wechselwirkungen des Zentralions mit seinen Liganden bestimmt. Dabei ist die Komplexbildungskonstante (\(K_{b}\)) das quantitative Maß dieser Interaktionen. Eine große Komplexbildungskonstante deutet auf eine starke Bindung der Liganden an das Zentralion hin und damit auf eine hohe Stabilität des Komplexes.
Die Rolle des Zentralions und des Liganden
Stell dir vor, das Zentralion ist ein Magnet und die Liganden sind metallische Gegenstände. Ein starker Magnet zieht die Metallstücke fester an – ähnlich zieht ein Zentralion, basierend auf seiner Ladung und Größe, Liganden unterschiedlich stark an. Stark geladene und kleinere Zentralionen neigen dazu, stärkere Bindungen zu bilden und somit stabilere Komplexe zu erzeugen.
Quantifizierung der Stabilität
Die Komplexbildungskonstante kann durch das folgende Gleichgewicht beschrieben werden:
\[ K_{b} = \frac{[\text{ML}_{n}]}{[\text{M}][\text{L}]^{n}} \]
Hierbei steht \([\text{ML}_{n}]\) für die Konzentration des Komplexes, \([\text{M}]\) für die Konzentration des Zentralions und \([\text{L}]\) für die Konzentration der Liganden. Ein hoher Wert für \(K_{b}\) sagt aus, dass das Gleichgewicht weitgehend auf der Seite des Komplexes liegt.
Das IMPP fragt gern nach dem Zusammenhang zwischen der thermodynamischen Stabilität und der Größe der Komplexbildungskonstante. Hier ist es besonders wichtig, dass ihr die Berechnung von \(K_{b}\) versteht und anwenden könnt.
Kinetische versus thermodynamische Stabilität
Thermodynamische Stabilität sagt aus, wie stark ein Komplex ist, die kinetische Stabilität hingegen, wie lange er lebt. Eine hohe kinetische Stabilität bedeutet, dass ein Komplex sich nur langsam bildet und zerfällt, was in einer geringen Reaktionsgeschwindigkeit resultiert.
Der Chelateffekt
Ein Schlüsselkonzept ist der Chelateffekt, welcher die erhöhte Stabilität von Komplexen beschreibt, die mehrzähnige Liganden besitzen. Dieser Effekt lässt sich durch die Entropiezunahme erklären, die auftritt, wenn ein mehrzähniger Ligand mehrere einzelne Liganden ersetzt:
\[ \text{A} + \text{B}_n \rightarrow \text{A(B}_n) + n \cdot \text{B} \]
Die Entropiezunahme, die durch die Freisetzung der einzelnen Liganden entsteht, treibt die Bildung des Komplexes thermodynamisch voran.
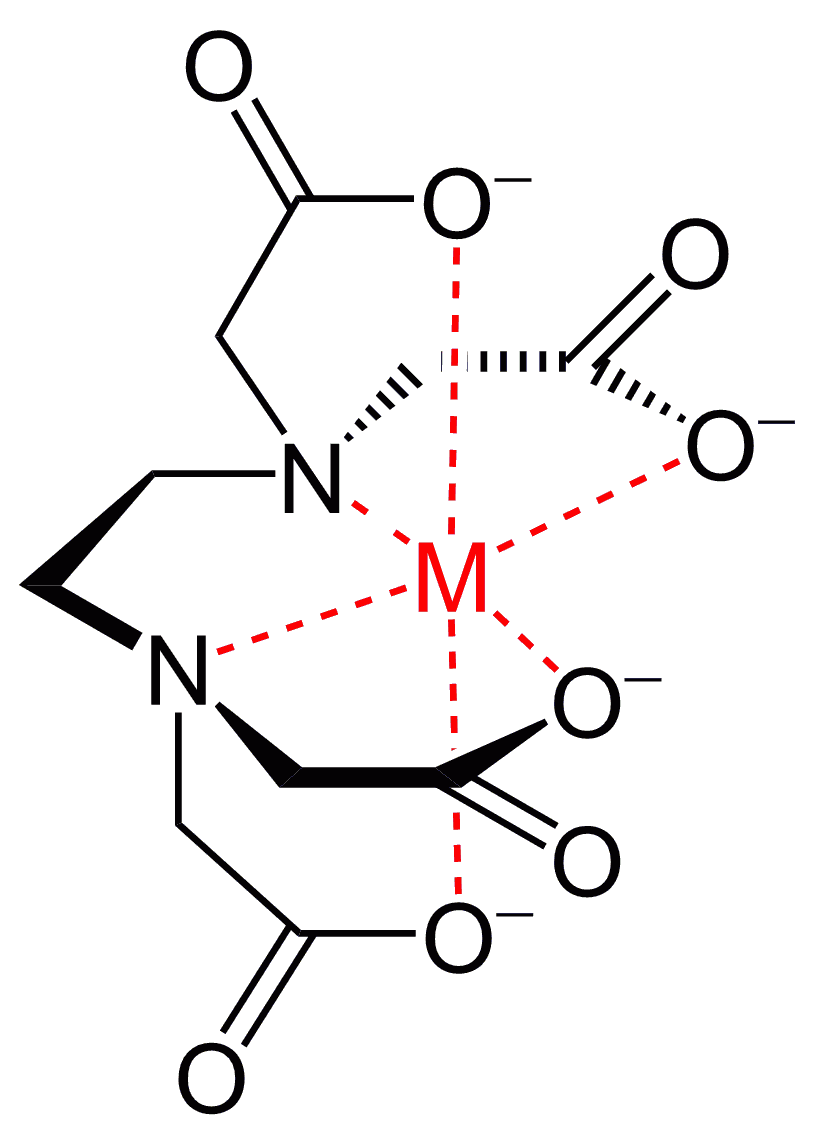
Beispiel: Einsatz von Lösungsmitteln
Acetonitril und Aceton bilden keine stabilen Chelatkomplexe und werden deshalb bevorzugt in chromatographischen Verfahren oder organischen Synthesen verwendet.
Der Einfluss spezieller Liganden
In einigen Fällen beeinflussen spezielle Liganden die Oxidationsstufe des Zentralions. So stabilisiert beispielsweise im Komplex \(\text{Na}_2[\text{Fe}(\text{CN})_5\text{NO}] \cdot 2 \text{H}_2\text{O}\) das Nitrosyl-Kation das Eisen in der Oxidationsstufe +2, während Cyanid ebenfalls zur Stabilität des Komplexes beiträgt.
Kompetitive Komplexformation
In der Chemie kann ein stabilerer Komplex andere verdrängen, was für das Verständnis chemischer Reaktionsmechanismen bedeutsam ist. Dies kann man sich wie eine Schlacht um das Zentralion vorstellen, bei der der stärkste Ligandensatz gewinnt.
Zusammenfassung
Feedback
Melde uns Fehler und Verbesserungsvorschläge zur aktuellen Seite über dieses Formular. Vielen Dank ❤️
Footnotes
Credits Chelatkomplex EDTA Grafik: Shaddack at English Wikipedia, Metal-EDTA, marked as public domain, more details on Wikimedia Commons↩︎