Hydrazin und Hydroxylamin
IMPP-Score: 0.4
Hydrazin und Hydroxylamin: Struktur, Eigenschaften und Reaktivität
Struktur und Eigenschaften von Hydrazin
Hydrazin (\(\mathrm{N_2H_4}\)) zeichnet sich durch eine molekulare Struktur aus, bei der zwei Stickstoffatome durch eine Einfachbindung verbunden sind. Beide Stickstoffatome befinden sich in sp^3-Hybridisierung. An jedes Stickstoffatom sind zwei Wasserstoffatome gebunden. Durch die Anwesenheit der beiden Stickstoffatome in Hydrazin ist es eine Verbindung mit zwei basischen Stellen, was bedeutet, dass es Protonen aufnehmen und als Brönsted-Base fungieren kann.
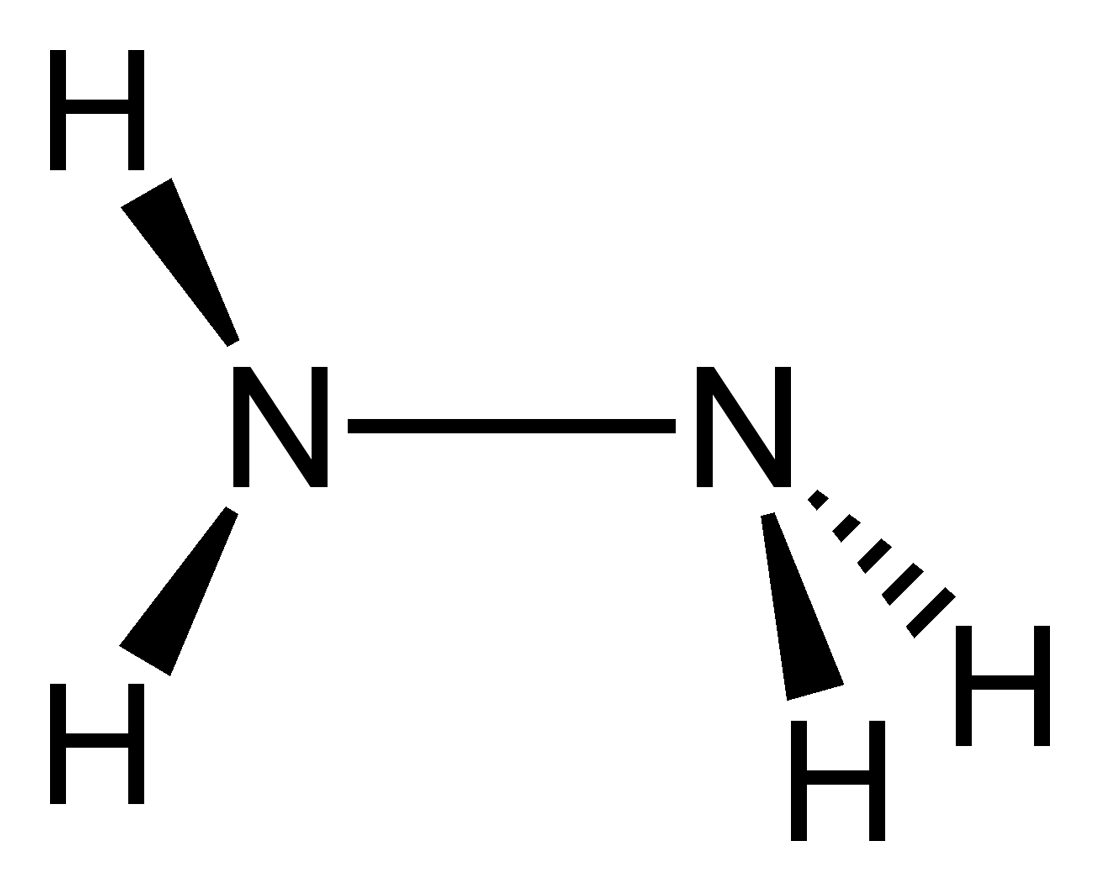
Die Basizität von Hydrazin ist jedoch geringer als die von Ammoniak. Dies lässt sich durch die Elektronegativität des Stickstoffs erklären, der die Elektronendichte der benachbarten -\(\mathrm{NH_2}\)-Gruppen herabzieht und somit die Basizität reduziert. Unter Normbedingungen liegt Hydrazin als flüssige, leicht flüchtige Substanz vor, die eine hohe Reaktivität aufweist. Sie kann durch das Raschig-Verfahren aus Ammoniak und Hypochlorit synthetisiert werden. Eine wichtige Eigenschaft von Hydrazin ist die Gefahr der explosionsartigen Zersetzung beim Erhitzen.
Struktur und Eigenschaften von Hydroxylamin
Hydroxylamin (\(\mathrm{NH_2OH}\)) hingegen ist eine farblose Verbindung und wird durch die Reduktion von Nitriten oder die Hydrierung von Stickstoffmonoxid (NO) erzeugt. Es besitzt am Stickstoffatom eine Oxidationszahl von -1 und am Sauerstoffatom eine Oxidationszahl von -2. Die Hydroxylgruppe übt einen induktiven Effekt aus, der die Basizität im Vergleich zu Ammoniak reduziert. Hydroxylamin findet als Reduktions- und Oxidationsmittel in verschiedenen Reaktionen der organischen Chemie Anwendung.
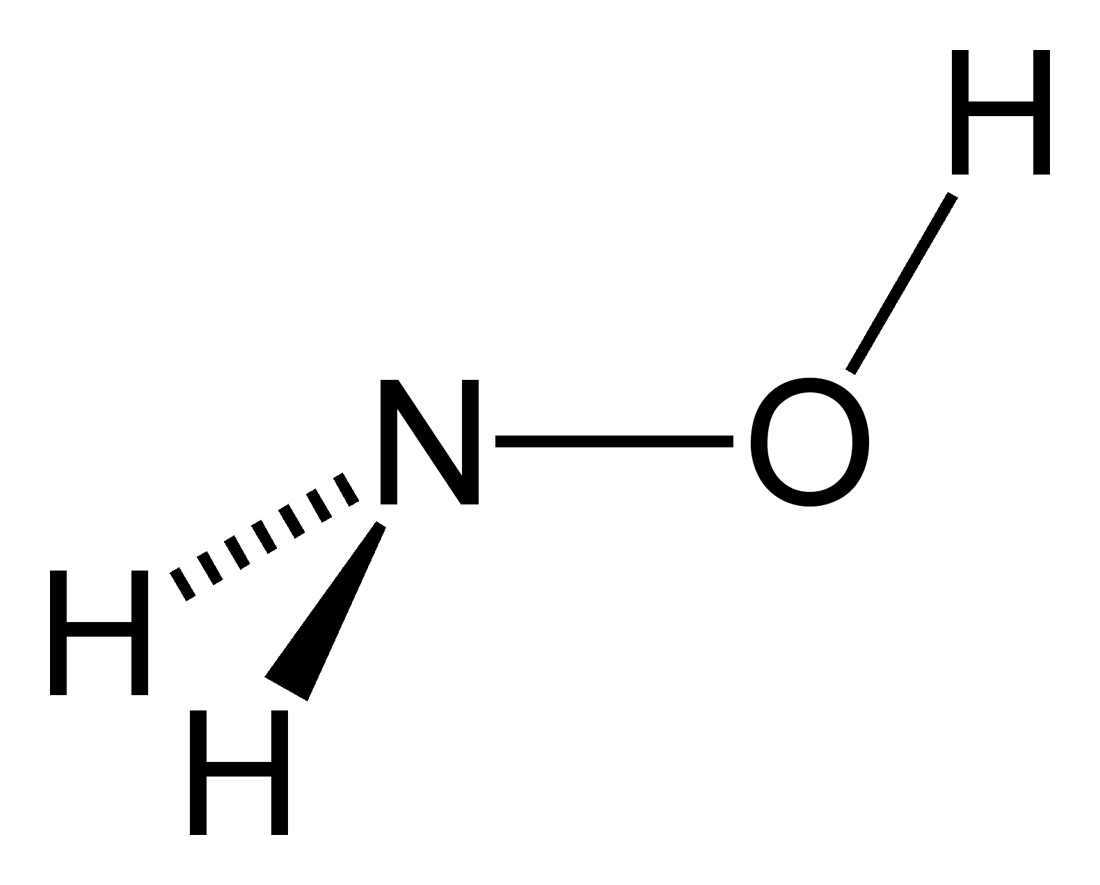
Beim Lernen für das Examen solltet ihr euch insbesondere mit der Oxidationszahl von Stickstoff in verschiedenen Verbindungen vertraut machen. Beispiele können das IMPP häufig abfragen.
Reaktivität von Hydrazin und Hydroxylamin
Hydrazin
- Protonenaufnahme: Hydrazin kann Protonen aufnehmen und in Lösung als Hydraziniumionen (\(\mathrm{N_2H_5^+}\)) vorliegen.
- Hydrazinhydrat: Durch Reaktion mit Wasser bildet Hydrazin das stabilere Hydrazinhydrat, welches stärker durch Wasserstoffbrückenbindungen stabilisiert ist.
- Reaktion mit Carbonylverbindungen: Hydrazin reagiert mit Ketogruppen zu Hydrazonen – eine wichtige Reaktion in der organischen Chemie.
Hydroxylamin
- Salzbildung: Durch Aufnahme von Protonen bildet Hydroxylamin beispielsweise das Hydroxylammoniumchlorid.
- Bildung von Oximen: Die Reaktion mit Aldehyden oder Ketonen führt zur Bildung von Oximen, welche als Intermediate in der organischen Synthese oder in analytischen Verfahren genutzt werden.
- Bildung von Hydroxamsäuren: In der Gegenwart von Basen reagiert Hydroxylamin mit Carbonsäurechloriden zu Hydroxamsäuren.
Praktische Relevanz und Sicherheitsaspekte
Hydrazin wird sehr oft als Raketentreibstoff oder in der Pharmaindustrie verwendet. Hydroxylamin findet Anwendung bei der Synthese von Medikamenten, Pestiziden und bei der fototechnischen Produktion. Sicherheitsaspekte sind von besonderer Bedeutung, da Hydrazin toxisch und explosiv ist. Mit Hydroxylamin muss ebenfalls vorsichtig umgegangen werden, da es reizend wirkt und ebenfalls toxisch ist.
Die praktische Relevanz von Hydrazin und Hydroxylamin in Industrie und Labor lässt vermuten, dass das IMPP auch die Kenntnis dieser Anwendungen prüft. Besonderes Augenmerk sollte auf die Reaktionen und Sicherheitsaspekte gelegt werden.
Insgesamt zeigt sich, dass sowohl Hydrazin als auch Hydroxylamin vielseitige Verbindungen der Stickstoffgruppe mit einzigartigen Strukturen und nützlichen Reaktionseigenschaften sind. Ihre Handhabung erfordert jedoch ein umfassendes Verständnis ihrer chemischen Eigenschaften, um ihre Potentiale sicher zu nutzen.
Zusammenfassung
Feedback
Melde uns Fehler und Verbesserungsvorschläge zur aktuellen Seite über dieses Formular. Vielen Dank ❤️
Footnotes
Credits Struktur von Hydrazin Grafik: Benjah-bmm27, Hydrazine-distances-2D, als gemeinfrei gekennzeichnet, Details auf Wikimedia Commons↩︎
Credits Struktur von Hydroxylamin Grafik: Autor unbekannt., Hydroxylamine-2D, als gemeinfrei gekennzeichnet, Details auf Wikimedia Commons↩︎
